
Pembahasan soal-soal Ujian Nasional SMA-IPA bidang studi Kimia dengan materi pembahasan Termokimia.
Soal tentang Termokimia UN 2015
Perhatikan proses-proses yang terjadi dalam kehidupan sehari-hari berikut ini!
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
- Pakaian basah menjadi kering setelah dijemur.
- Pembakaran gas elpiji.
- Logam/besi dilelehkan pada proses pengelasan.
- Perkaratan besi.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Reaksi endoterm adalah reaksi yang membutuhkan kalor atau energi. Sedangkan reaksi eksoterm adalah reaksi yang menghasilkan kalor atau energi.- Pakaian basah menjadi kering karena menyerap energi matahari (endoterm).
- Pembakaran gas elpiji akan menghasilkan panas di antaranya untuk memasak (eksoterm).
- Logam meleleh karena mendapat kalor dari alat pengelasan (endoterm).
- Perkaratan besi merupakan reaksi oksidasi yang melepas kalor (eksoterm).
Soal tentang Termokimia UN 2014
Beberapa proses/reaksi kimia yang terjadi di alam sebagai berikut:
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
- 6CO2 (g) + 6H2O (l) → C6H12O6 (s) + 6O2 (g)
- 4Fe (s) + 3O2 (g) + xH2O (l) → 2Fe2O3.xH2O (s)
- C6H12O6 (s) + 6O2 (g) → 6CO2 (g) + 6H2O (l)
- H2O (l) → H2O (g)
- C (s) + H2O (g) → CO (g) + H2 (g)
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)

Pembahasan
Penjelasan tentang reaksi yang disajikan pada soal adalah sebagai berikut:- 6CO2 + 6H2O → C6H12O6 + 6O2. Reaksi ini adalah reaksi fotosintesis. Reaksi fotosintesis membutuhkan energi matahari (endoterm).
- 4Fe + 3O2 + xH2O → 2Fe2O3.xH2O adalah reaksi perkaratan pada besi. Reaksi perkaratan merupakan reaksi oksidasi yang melepas kalor (eksoterm).
- C6H12O6 + 6O2 → 6CO2 + 6H2O. Ini merupakan kebalikan reaksi fotosintesis atau reaksi pembakaran karbohidrat. Semua reaksi pembakaran menghasilkan energi (eksoterm).
- H2O (l) → H2O (g) adalah reaksi perubahan wujud dari air menjadi uap. Reaksi penguapan membutuhkan energi, misal energi matahari (endoterm).
- C (s) + H2O (g) → CO (g) + H2 (g) adalah reaksi yang digunakan dalam produksi 'gas air' (water gas). Reaksi ini memerlukan kalor (endoterm)
Soal tentang Termokimia UN 2012
Perhatikan persamaan reaksi termokimia di bawah ini!
A. 3, 4, dan 5
B. 2, 4, dan 5
C. 1, 3, dan 5
D. 1, 2, dan 4
E. 1, 2, dan 3
- ½ N2 (g) + ½ O2 (g) → NO (g) ΔH = +kJ/mol
- NO2 (g) → ½ N2 (g) + O2 (g) ΔH = −kJ/mol
- CO2 (g) → C (s) + O2 (g) ΔH = +kJ/mol
- C2H5OH + 3O2 → 2CO2 + 3H2O ΔH = −kJ/mol
- Na (s) + ½ Cl2 (g) → NaCl ΔH = −kJ/mol
A. 3, 4, dan 5
B. 2, 4, dan 5
C. 1, 3, dan 5
D. 1, 2, dan 4
E. 1, 2, dan 3
Pembahasan
Ada tiga jenis kalor reaksi (perubahan entalpi reaksi):- Kalor Pembentukan (ΔHfo), yaitu kalor yang diperlukan (endoterm) atau kalor yang dibebaskan (eksoterm) pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya. Persamaan reaksi yang merupakan ΔHfo adalah nomor 1 (pembentukan NO) dan nomor 5 (pembentukan NaCl).
- Kalor Penguraian (ΔHdo), yaitu kalor yang diperlukan atau kalor yang dibebaskan pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya. Persamaan reaksi yang merupakan ΔHdo adalah nomor 2 (penguraian NO2) dan nomor 3 (penguraian CO2).
- Kalor Pembakaran (ΔHco), yaitu kalor yang dibebaskan (selalu eksoterm) pada pembakaran 1 mol zat (unsur/senyawa) dengan oksigen. Persamaan reaksi yang merupakan ΔHco adalah nomor 4 (pembakaran C2H5OH). Persamaan reaksi nomor 1 tidak bisa dikatakan pembakaran N2 karena koefisien N2 tidak sama dengan 1.
Soal tentang Termokimia UN 2014
Perhatikan kalor reaksi pembentukan air berikut!
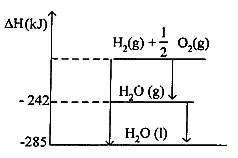
Pada penguapan 2 mol air dari tubuh diperlukan energi sebesar ….
A. 570 kJ
B. 484 kJ
C. 242 kJ
D. 86 kJ
E. 43 kJ

Pada penguapan 2 mol air dari tubuh diperlukan energi sebesar ….
A. 570 kJ
B. 484 kJ
C. 242 kJ
D. 86 kJ
E. 43 kJ
Pembahasan
Penguapan adalah perubahan wujud air dari fase cair ke fase gas.H2O (l) → H2O (g)
Berdasarkan grafik di atas, perubahan entalpinya adalah
ΔH = ΔHhasil − ΔHpereaksi
= −242 − (−285)
= −242 + 285
= 43
Nilai 43 adalah energi yang diperlukan pada penguapan 1 mol air. Untuk penguapan 2 mol air diperlukan energi dua kalinya.
ΔH = 2 × 43
= 86
Jadi, energi yang diperlukan dalam penguapan 2 mol air adalah 86 kJ (D).
Soal tentang Termokimia UN 2013
Perhatikan persamaan reaksi termokimia berikut!
K(s) + 1/2 N2(g) + 3/2 O2(g) → KNO3(s) ΔHfo = −495 kJ/mol
Grafik yang menunjukkan proses reaksi tersebut adalah ….
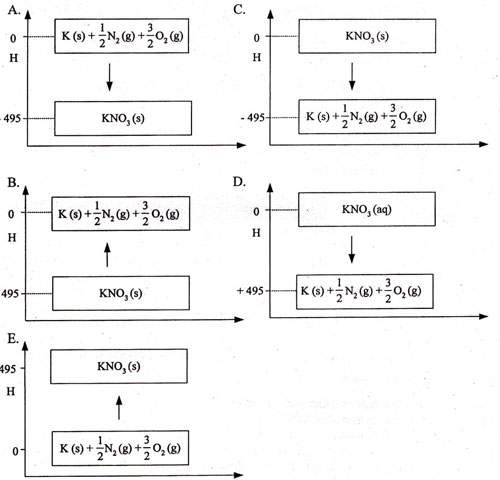
K(s) + 1/2 N2(g) + 3/2 O2(g) → KNO3(s) ΔHfo = −495 kJ/mol
Grafik yang menunjukkan proses reaksi tersebut adalah ….

Pembahasan
Bila diperhatikan reaksi di atas:- KNO3 sebagai hasil reaksi maka arah panah menuju ke KNO3
- ΔHfo bernilai negatif maka arah panahnya ke arah bawah
Pembahasan soal Termokimia yang lain bisa disimak di:
Pembahasan Kimia UN 2014 No. 27 dan 28
Pembahasan Kimia UN 2015 No. 25
Pembahasan Kimia UN 2015 No. 26 dan 27
Pembahasan Kimia UN 2016 No. 20
Pembahasan Kimia UN 2016 No. 22
Pembahasan Kimia Un 2017 No. 18 dan 19
Pembahasan Kimia UN 2018 No. 14
Pembahasan Kimia UN 2018 No. 26 dan 29
Pembahasan Kimia UN 2019 No. 15
Pembahasan Kimia UN 2019 No. 16
Simak juga, Pembahasan Kimia UN: Laju Reaksi.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan