
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2018 nomor 11 sampai dengan nomor 15 tentang:
- hidrolisis garam,
- pH asam basa,
- kelarutan dan hasil kali kelarutan,
- termokimia, serta
- laju reaksi.
Soal No. 11 tentang Hidrolisis Garam
Perhatikan tabel persamaan reaksi hidrolisis garam berikut ini!

Pasangan data garam terhidrolisis yang tepat adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (3)
E. (2) dan (4)

Pasangan data garam terhidrolisis yang tepat adalah ….
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (3)
E. (2) dan (4)
Pembahasan
Hidrolisis garam adalah reaksi penguraian garam dalam air. Jika garam tersebut bersifat asam maka akan terbentuk ion H+ atau H3O+. Sedangkan bila garam tersebut bersifat basa maka akan terbentuk ion OH−.Mari kita periksa satu per satu!
- CH3COONa ⟶ CH3COO− + Na+
Garam CH3COONa bersifat basa (pH > 7) karena berasal dari asam lemah CH3COOH dan basa kuat NaOH. Yang terhidrolisis dalam air adalah ion yang berasal dari asam lemah.
CH3COO− + H2O ⇌ CH3COOH + OH−
[pernyataan 1 benar]
- Garam CaSO3 ⟶ Ca2+ + SO32−
Garam CaSO3 bersifat basa (pH > 7) karena berasal dari basa kuat Ca(OH)2 dan asam lemah H2SO3. Yang terhidrolisis dalam air adalah ion yang berasal dari asam lemah.
SO32− + H2O ⇌ HSO3− + OH−
[pernyataan 2 salah]
- (NH4)2SO4 ⟶ 2NH4+ + SO42−
Garam (NH4)2SO4 bersifat asam (pH < 7) karena berasal dari basa lemah NH4OH dan asam kuat H2SO4. Yang terhidrolisis dalam air adalah ion yang berasal dari basa lemah.
NH4+ + H2O ⇌ NH4OH + H+ atau
NH4+ + H2O ⇌ NH3 + H3O+
[pernyataan 3 benar]
- (NH4)3PO4 ⟶ 3NH4+ + PO43−
Garam (NH4)3PO4 berasal dari asam lemah H3PO4 dan basa lemah NH4OH sehingga keduanya mengalami hidrolisis (hidrolisis total).
PO43− + H2O ⇌ HPO42− + OH−Jadi, pasangan data garam terhidrolisis yang tepat adalah pernyataan 1 dan 3 (B).
NH4+ + H2O ⇌ NH3 + H3O+
[pernyataan 4 salah]
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam
Soal No. 12 tentang pH Asam Basa
Diketahui data beberapa indikator dan trayek pH.
Berikut ini adalah kurva titrasi asam-basa.
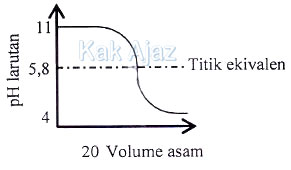
Pasangan asam-basa/basa-asam dan indikator yang digunakan berturut-turut adalah ….
A. KOH – CH3COOH – fenolftalein
B. KOH – HCl – fenolftalein
C. CH3NH3 – HCl – metil jingga
D. NH4OH – CH3COOH – metil jingga
E. NaOH – HCl – fenolftalein
| Indikator | Metil jingga | Bromtimol biru | Fenolftalein |
| Trayek pH | 3,1 – 4,40 | 6,0 – 7,6 | 8,3 – 10,0 |
Berikut ini adalah kurva titrasi asam-basa.

Pasangan asam-basa/basa-asam dan indikator yang digunakan berturut-turut adalah ….
A. KOH – CH3COOH – fenolftalein
B. KOH – HCl – fenolftalein
C. CH3NH3 – HCl – metil jingga
D. NH4OH – CH3COOH – metil jingga
E. NaOH – HCl – fenolftalein

Pembahasan
Titik ekuivalen kurva titrasi terjadi pada pH = 5,8. Hal ini berarti:- Titrasi terjadi antara asam kuat dan basa lemah. Di antara opsi jawaban, yang termasuk basa lemah dan asam kuat adalah CH3NH3 – HCl.
- Titik ekuivalen masuk dalam trayek asam lemah (3 – 6). Sehingga indikator yang tepat adalah metil jingga.
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa
Soal No. 13 tentang Kelarutan dan Hasil Kali Kelarutan
Diketahui Ksp Mg(OH)2 = 6 × 10−12. Dua buah larutan dicampur dengan komposisi sebagai berikut:
Pasangan campuran yang menghasilkan endapan Mg(OH)2 ditunjukkan pada nomor ….
A. (1) dan (4) karena harga Qc < Ksp
B. (1) dan (5) karena harga Qc > Ksp
C. (2) dan (3) karena harga Qc < Ksp
D. (2) dan (4) karena harga Qc > Ksp
E. (3) dan (5) karena harga Qc < Ksp
| No. | Mg(NO3)2 | KOH |
| (1) | 200 mL, 10−3 M | 200 mL, 10−5 M |
| (2) | 100 mL, 10−4 M | 100 mL, 10−3 M |
| (3) | 400 mL, 10−5 M | 400 mL, 10−4 M |
| (4) | 250 mL, 10−3 M | 250 mL, 10−3 M |
| (5) | 500 mL, 10−5 M | 500 mL, 10−5 M |
Pasangan campuran yang menghasilkan endapan Mg(OH)2 ditunjukkan pada nomor ….
A. (1) dan (4) karena harga Qc < Ksp
B. (1) dan (5) karena harga Qc > Ksp
C. (2) dan (3) karena harga Qc < Ksp
D. (2) dan (4) karena harga Qc > Ksp
E. (3) dan (5) karena harga Qc < Ksp
Pembahasan
Untuk menentukan apakah suatu campuran menghasilkan endapan atau tidak, kita harus menentukan harga Qc, yaitu hasil kali konsentrasi ion-ion pangkat koefisien masing-masing. Selanjutnya harga Qc tersebut kita bandingkan dengan harga Ksp.- Qc < Ksp : larut (belum jenuh)
- Qc = Ksp : larut (tepat jenuh)
- Qc > Ksp : mengendap (lewat jenuh)
Mg(OH)2 → Mg2+ + 2OH−
Qc = [Mg2+] [OH−]2
Harga [Mg2+] kita dapatkan dari molaritas Mg(NO3)2 sedangkan harga [OH−] kita dapatkan dari KOH.
| No. | [Mg2+] | [OH−] | Qc = [Mg2+] [OH−]2 | Ksp | Ket |
| (1) | 10−3 | 10−5 | 10−13 | 6 × 10−12 | Qc < Ksp |
| (2) | 10−4 | 10−3 | 10−10 | Qc > Ksp | |
| (3) | 10−5 | 10−4 | 10−13 | Qc < Ksp | |
| (4) | 10−3 | 10−3 | 10−9 | Qc > Ksp | |
| (5) | 10−5 | 10−5 | 10−15 | Qc < Ksp |
Jadi, pasangan campuran yang menghasilkan endapan Mg(OH)2 ditunjukkan pada nomor 2 dan 4 (D).
Perdalam materi ini di Pembahasan Kimia UN: Kelarutan dan Hasil Kali Kelarutan
Soal No. 14 tentang Termokimia
Jika kita memasukkan bongkahan batu kapur ke dalam air, akan terjadi gelembung-gelembung gas dan wadah akan terasa panas.
Pernyataan yang benar dari data percobaan tersebut adalah …
A. Reaksi tersebut merupakan reaksi eksoterm karena sistem menyerap kalor dari lingkungan.
B. Reaksi tersebut merupakan reaksi endoterm karena lingkungan menyerap kalor dari sistem.
C. Reaksi tersebut merupakan reaksi eksoterm karena sistem melepas kalor ke lingkungan.
D. Reaksi tersebut merupakan reaksi endoterm karena lingkungan menerima kalor dari sistem.
E. Reaksi tersebut merupakan reaksi eksoterm karena lingkungan melepas kalor ke sistem.
Pernyataan yang benar dari data percobaan tersebut adalah …
A. Reaksi tersebut merupakan reaksi eksoterm karena sistem menyerap kalor dari lingkungan.
B. Reaksi tersebut merupakan reaksi endoterm karena lingkungan menyerap kalor dari sistem.
C. Reaksi tersebut merupakan reaksi eksoterm karena sistem melepas kalor ke lingkungan.
D. Reaksi tersebut merupakan reaksi endoterm karena lingkungan menerima kalor dari sistem.
E. Reaksi tersebut merupakan reaksi eksoterm karena lingkungan melepas kalor ke sistem.
Pembahasan
Berikut ini ciri reaksi eksoterm dan endoterm.| Reaksi Eksoterm | Reaksi Endoterm |
| sistem melepas/membebaskan/ menghasilkan kalor | sistem menyerap/ membutuhkan/memerlukan kalor |
| kalor mengalir dari sistem ke lingkungan | kalor mengalir dari lingkungan ke sistem |
| suhu lingkungan naik | suhu lingkungan turun |
| perubahan entalpi negatif (∆H < 0) | perubahan entalpi positif (∆H > 0) |
| entalpi produk lebih kecil daripada entail reaktan | entalpi produk lebih besar daripada entail reaktan |
| menghasilkan energi | memerlukan energi |
| contoh: proses respirasi | contoh: proses fotosintesis |
Saat batu kapur dimasukkan ke dalam air, wadah akan terasa panas, berarti suhu lingkungan naik. Hal ini terjadi karena sistem melepas kalor ke lingkungan. Sehingga reaksi di atas termasuk reaksi eksoterm.
Jadi, pernyataan yang benar dari data percobaan tersebut adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia
Soal No. 15 tentang Laju Reaksi
Diketahui data percobaan reaksi 2A + B2 → 2AB.
Grafik yang menunjukkan orde reaksi dari A adalah ….
![Grafik kecepatan reaksi terhadap [A] Grafik kecepatan reaksi terhadap [A], opsi jawaban soal no. 15 Kimia UN 2018](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEijwbNJaSnCYLf3HFvNdd5WHJOJVhl4CzSBuT-F2XCMrGuhY0g7pfetCkVXww4OxGa9AvOzzUOqdVQQoT3MR95BLv9J0o1It5F3_N1aPF7ieEbECCQLrR3Oa3rSLHYPsmzk1QR4sqU0kw/s1600/grafik-kec-reaksi.jpg)
| Percobaan | [A] M | [B] M | Waktu | v (m/detik) |
| (1) | a | b | 288 s | 16 |
| (2) | 2a | b | 72 s | 64 |
| (3) | 3a | 2b | 16 s | 72 |
Grafik yang menunjukkan orde reaksi dari A adalah ….
![Grafik kecepatan reaksi terhadap [A] Grafik kecepatan reaksi terhadap [A], opsi jawaban soal no. 15 Kimia UN 2018](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEijwbNJaSnCYLf3HFvNdd5WHJOJVhl4CzSBuT-F2XCMrGuhY0g7pfetCkVXww4OxGa9AvOzzUOqdVQQoT3MR95BLv9J0o1It5F3_N1aPF7ieEbECCQLrR3Oa3rSLHYPsmzk1QR4sqU0kw/s1600/grafik-kec-reaksi.jpg)
Pembahasan
Orde reaksi A ditentukan saat nilai [B] tetap, yaitu percobaan (1) dan (2).Selanjutnya kita bandingkan antara nilai [A] terhadap waktu atau kecepatan. Bila kita bandingkan dengan waktu maka berbanding terbalik. Sedangkan bila kita bandingkan dengan kecepatan maka berbanding lurus.
Ok, Kak Ajaz lebih suka yang berbanding lurus.
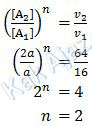
Sehingga persamaan laju reaksinya adalah:
v = k [A]2 [B]m
Dengan demikian, hubungan antara v terhadap [A] adalah:
v ~ [A]2
Berarti grafik v - [A] adalah grafik kuadrat atau parabola.
Jadi, grafik yang menunjukkan orde reaksi dari A adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Laju Reaksi
Simak Pembahasan Soal Kimia UN 2018 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan