
Pembahasan soal-soal Ujian Nasional (UN) SMA-IPA bidang studi Kimia dengan materi pembahasan Sifat Koligatif Larutan.
Soal Sifat Koligatif Larutan UN 2013
Bagan berikut ini adalah gambaran molekuler larutan dengan berbagai konsentrasi.

Gambar yang menunjukkan titik didih larutan paling besar adalah nomor ….
A. I
B. II
C. III
D. IV
E. V

Gambar yang menunjukkan titik didih larutan paling besar adalah nomor ….
A. I
B. II
C. III
D. IV
E. V
Pembahasan
Perhatikan rumus kenaikan titik didih berikut ini!
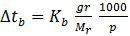
Berdasarkan rumus di atas, kenaikan titik didih (Δtb) berbanding lurus dengan jumlah mol partikel zat terlarut (gr/Mr). Artinya, semakin besar jumlah mol partikel zat terlarut semakin besar pula kenaikan titik didihnya.
Jadi, titik didih larutan paling besar ditunjukkan oleh gambar yang mempunyai partikel zat terlarut (bulatan hitam) yang paling banyak, yaitu gambar II (B).
Soal Sifat Koligatif Larutan UN 2011
Gambar berikut merupakan gambar partikel zat terlarut dan pelarut yang bukan sebenarnya.

Tekanan uap larutan paling kecil terdapat pada wadah ….
A. 1
B. 2
C. 3
D. 4
E. 5

Tekanan uap larutan paling kecil terdapat pada wadah ….
A. 1
B. 2
C. 3
D. 4
E. 5

Pembahasan
Perhatikan rumus tekanan uap larutan berikut ini!p = po xpBerdasarkan rumus di atas, tekanan uap larutan (p) sebanding dengan fraksi mol pelarut (xp). Artinya, jika fraksi mol pelarut kecil maka tekanan uap pelarut juga kecil.
Jadi, tekanan uap yang paling kecil terdapat pada wadah yang mempunyai jumlah partikel pelarut (bulatan hitam) paling sedikit, yaitu wadah nomor 1 (A).
Soal Sifat Koligatif Larutan UN 2015
Berikut adalah beberapa pemanfaatan sifat koligatif larutan yang banyak ditemui dalam kehidupan sehari-hari:
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
- penggunaan cairan infus bagi manusia,
- pembuatan cairan pendingin pada es putar,
- penggunaan obat tetes mata,
- pencairan salju menggunakan garam dapur,
- pemberian garam pada lintah.
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
Pembahasan
Mari kita ulas satu per satu pernyataan-pernyataan di atas!- Cairan infus dibuat dengan tekanan yang lebih rendah daripada tekanan osmotik darah sehingga cairan infus dapat terserap oleh sel-sel darah. [pernyataan 1 salah]
- Cairan pendingin pada es putar dibuat dengan mencampurkan garam dapur dengan kepingan es. Tujuannya untuk menurunkan titik beku es sehingga es mencair. [pernyataan 2 benar]
- Obat tetes mata dibuat dengan tekanan lebih rendah sehingga dapat terserap oleh mata. [pernyataan 3 salah]
- Penggunaan garam dapur pada salju bertujuan untuk menurunkan titik beku salju sehingga salju mencair. [pernyataan 4 benar]
- Pemberian garam pada lintah menyebabkan peristiwa osmosis sehingga cairan dalam tubuh lintah akan keluar sehingga lintah mati karena kekurangan cairan tubuh. [pernyataan 5 salah]
Soal Sifat Koligatif Larutan UN 2014
Berikut ini peristiwa kimia dalam kehidupan sehari-hari:
A. penurunan tekanan uap dan tekanan osmotik
B. tekanan osmotik dan kenaikan titik didih
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan osmosis balik
E. penurunan titik beku dan kenaikan titik didih
- etilen glikol dapat ditambahkan ke dalam radiator mobil, dan
- desalinasi air laut.
A. penurunan tekanan uap dan tekanan osmotik
B. tekanan osmotik dan kenaikan titik didih
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan osmosis balik
E. penurunan titik beku dan kenaikan titik didih
Pembahasan
Di antara penerapan sifat koligatif larutan adalah sebagai berikut:- Penambahan etilen glikol dimaksudkan untuk menurunkan titik beku air radiator sehingga tidak cepat membeku.
- Desalinasi air laut adalah pembuatan air murni yang berasal dari air laut. Pada pembuatan ini terjadi peristiwa osmosis balik, yaitu merembesnya H2O dari air laut melalui membran semipermeabel.
Soal Sifat Koligatif Larutan UN 2012
Berikut ini dua buah contoh peristiwa kimia:
A. penurunan titik beku dan tekanan osmotik
B. tekanan osmotik dan penurunan titik beku
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan kenaikan titik didih
E. tekanan osmotik dan kenaikan titik didih
- Pemakaian urea untuk mencairkan salju.
- Produksi air tawar dari air laut.
A. penurunan titik beku dan tekanan osmotik
B. tekanan osmotik dan penurunan titik beku
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan kenaikan titik didih
E. tekanan osmotik dan kenaikan titik didih
Pembahasan
Pemakaian urea yang ditaburkan pada salju bertujuan untuk menurunkan titik beku salju sehingga salju mencair.Produksi air tawar dari air laut dikenal dengan istilah desalinasi air laut. Tekanan permukaan air laut dibuat lebih tinggi daripada tekanan osmotiknya sehingga terjadi osmosis balik, yaitu merembesnya H2O dari air asin ke air murni melalui membran semipermeabel.
Jadi, pemakaian urea pada salju dan produksi air tawar dari air laut berkaitan dengan penurunan titik beku dan tekanan osmotik (A).
Pembahasan soal Sifat Koligatif Larutan yang lain bisa dilihat di:
Pembahasan Kimia UN 2015 No. 9.
Pembahasan Kimia UN 2016 No. 28 dan 29
Pembahasan Kimia UN 2017 No. 31 dan 32
Pembahasan Kimia UN 2018 No. 17 dan 19
Pembahasan Kimia UN 2018 No. 24 dan 25
Pembahasan Kimia UN 2019 No. 21 - 23
Simak juga, Pembahasan Kimia UN: Reaksi Redoks dan Elektrokimia.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

IJIN COPAS YA PAK , MKSH
ReplyDeleteSilakan, mbak Tary. Jika tidak keberatan, sertakan sumbernya.
Deleteijin copas juga ya pak, kreatif.. memang ini lagi dicari anak kls xii dan gurunya juga
ReplyDeleteSilakan mbak Arbain. Semoga bermanfaat.
DeleteTerimakasih banyak pak, ulasannya sangat dimengertii< saya suka saya suka :D
ReplyDeleteTerima kasih kembali. Semoga lebih semangat belajar.
DeleteMakasih banyak kak ajaz^^ aku sekarang jadi ngerti. Lagi kelabakan udah mau UN tapi masih belum ngerti, eh ketemu blog kaka. Jadi minat beli ebooknya juga. mau nanya, itu ebooknya isi pembahasan soal2 yg kaya ada di halaman ini atau lebih banyak lagi soal yang dibahas? tq kak.
ReplyDeleteTerima kasih kembali atas atensinya terhadap blog ini.
DeleteIsi ebook sama dengan yang ada di blog ini. Ebook tersebut ditujukan bagi mereka yang ingin belajar berlama-lama dan berulang-ulang tanpa terkendala kuota internet. Penulisannya juga lebih rapi dan dapat di-print karena ditulis dalam file pdf.
makasi ya sangat membantu sekali.
ReplyDeleteSama-sama. Semoga berkah
DeleteSangat membantu :)
ReplyDeleteTerima kasih
Deleteterima kasih
ReplyDeleteSama-sama. Semoga bermanfaat
DeleteGbu <3
ReplyDeleteThanks
DeleteTerima kasih, ini luar biasa sangat membantu 💜
ReplyDeleteTerima kasih juga atas apresiasinya
Delete