
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 21 sampai dengan nomor 25 tentang:
- sifat koligatif larutan [kenaikan titik didih],
- sifat koligatif larutan,
- sifat koligatif larutan elektrolit,
- bilangan oksidasi, serta
- reaksi reduksi dan oksidasi.
Soal No. 21 tentang Sifat Koligatif Larutan [kenaikan titik didih]
Suatu larutan glukosa (Mr = 180) dilarutkan dalam 100 gram air dan mendidih pada suhu 100,65 ℃. Jika Kb air = 0,52 ℃.Kg/mol, massa glukosa yang dilarutkan adalah ….
A. 5,6 gram
B. 11,2 gram
C. 22,5 gram
D. 45,0 gram
E. 67,5 gram
A. 5,6 gram
B. 11,2 gram
C. 22,5 gram
D. 45,0 gram
E. 67,5 gram
Pembahasan
Diketahui:Mr = 180
gr = 100 gram
p = 100
Kb = 0,52 ℃.Kg/mol
∆tb = 100,65 ℃-100 ℃
= 0,65 ℃
Massa glukosa bisa dicari dari rumus kenaikan titik didih berikut:
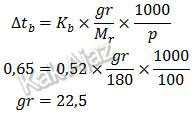
Jadi, massa glukosa yang dilarutkan adalah 22,5 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 22 tentang Sifat koligatif Larutan
Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut!
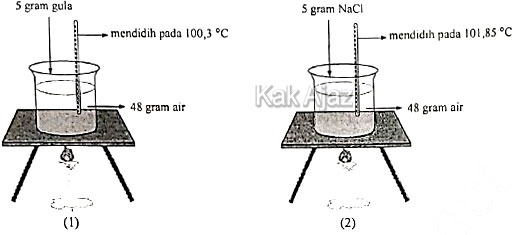
Jika Mr NaCl = 58,5, Mr glukosa = 180 dan tb air = 100 ℃, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah ….
A. 0,52 ℃/mol
B. 0,54 ℃/mol
C. 0,55 ℃/mol
D. 0,56 ℃/mol
E. 0,57 ℃/mol

Jika Mr NaCl = 58,5, Mr glukosa = 180 dan tb air = 100 ℃, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah ….
A. 0,52 ℃/mol
B. 0,54 ℃/mol
C. 0,55 ℃/mol
D. 0,56 ℃/mol
E. 0,57 ℃/mol
Pembahasan
Berdasarkan data dan keterangan pada gambar, diperoleh:Untuk larutan glukosa
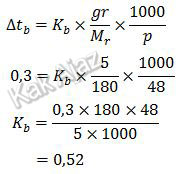
Untuk larutan garam NaCl

Jadi, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah 0,52 ℃/mol (A).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 23 tentang Sifat Koligatif Larutan Elektrolit
Perhatikan beberapa larutan garam dengan konsentrasi sama berikut!
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
- Kalsium karbonat.
- Barium klorida.
- Besi (III) klorida
- Aluminium sulfat
- Kalium nitrat
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)

Pembahasan
Karena konsentrasinya sama, titik beku hanya bergantung pada jumlah partikel (ion). Dalam hal ini i = n.| Kalsium karbonat | : | CaCO3 | i = 2 |
| Barium klorida | : | BaCl2 | i = 3 |
| Besi (III) klorida | : | FeCl3 | i = 4 |
| Aluminium sulfat | : | Al2(SO4)3 | i = 5 |
| Kalium nitrat | : | KNO3 | i = 2 |
Berdasarkan rumus penurunan titik beku:

Bila nilai i besar maka nilai ∆tf ikut besar.
Sedangkan berdasarkan rumus:
∆tf = 0 − tf
Bila nilai ∆tf besar maka nilai tf juga ikut besar tetapi bertanda negatif. Dengan kata lain, bila ∆tf besar maka tf rendah.
Jadi, larutan gram yang mempunyai titik beku paling rendah adalah aluminium sulfat (D).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 24 tentang Bilangan Oksidasi
Bilangan oksidasi belerang dalam aluminium sulfat Al2(SO4)3 dan ion SO32− berturut-turut adalah ….
A. −4 dan +4
B. −2 dan +2
C. +2 dan +3
D. +4 dan +2
E. +6 dan +4
A. −4 dan +4
B. −2 dan +2
C. +2 dan +3
D. +4 dan +2
E. +6 dan +4
Pembahasan
Aluminium (Al) adalah golongan IIIA sehingga bilangan oksidasinya = +3.Al2(SO4)3 → 2Al3+ + 3SO42−
Bilangan oksidasi S kiat cari dari ion SO42− saja supaya lebih angkanya sederhana.
SO42− = S + 4(−2) [biloks O = −2]
−2 = S − 8
S = +6
Selanjutnya kita cari biloks dari SO32−.
SO32− = S + 3(−2)
−2 = S − 6
S = +4
Jadi, bilangan oksidasi belerang dalam aluminium sulfat Al2(SO4)3 dan ion SO32− berturut-turut adalah +6 dan +4 (E).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Reduksi dan Oksidasi.
Soal No. 25 tentang Reaksi Reduksi dan Oksidasi
Baterai nikel-kadmium (nikad) merupakan baterai isi ulang pertama dan yang paling murah sehingga banyak digunakan pada mainan anak-anak dan berbagai gawai. Reaksi yang terjadi pada saat baterai digunakan:
Cd(s) + NiO2(aq) + 2H2O(l) ⇌ Cd(OH)2(s) + Ni(OH)2(s)
Spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah ….
A. Cd, karena mengalami kenaikan bilangan oksidasi
B. NiO2, karena mengalami kenaikan bilangan oksidasi
C. H2O, karena mengalami kenaikan bilangan oksidasi
D. Cd, karena mengalami penurunan bilangan oksidasi
E. NiO2, karena mengalami penurunan bilangan oksidasi
Cd(s) + NiO2(aq) + 2H2O(l) ⇌ Cd(OH)2(s) + Ni(OH)2(s)
Spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah ….
A. Cd, karena mengalami kenaikan bilangan oksidasi
B. NiO2, karena mengalami kenaikan bilangan oksidasi
C. H2O, karena mengalami kenaikan bilangan oksidasi
D. Cd, karena mengalami penurunan bilangan oksidasi
E. NiO2, karena mengalami penurunan bilangan oksidasi
Pembahasan
Perhatikan perubahan biloks di bawah ini!

Berdasarkan gambar di atas dapat disimpulkan bahwa Cd bertindak sebagai reduktor karena mengalami kenaikan biloks. Sedangkan NiO2 bertindak sebagai oksidator karena mengalami peranan biloks.
Jadi, spesi kimia yang bertindak sebagai reduktor pada saat baterai digunakan adalah Cd, karena mengalami kenaikan bilangan oksidasi (A).
Perdalam materi ini di Pembahasan Kimia UN: Reaksi Reduksi dan Oksidasi.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

Salam,Ka..
ReplyDeleteUntuk nomor 23, sepertinya jawaban seharusnya Aluminium sulfat {Al2(SO4)3}.
Coba diricek lagi, Ka
Salam juga,
DeleteTerima kasih atas koreksinya. Mungkin yang terbaca di pikiran saya waktu itu amonium sulfat sehingga tertulis (NH4)2SO4. Hehehehe...
Sekali lagi terima kasih, kesalahan sudah saya perbaiki.
Salam, ingin bertanya kau i pada no 22 yg NaCl dari mana ya kak?
ReplyDeleteSalam juga,
Deletei pada soal no. 22 adalah banyaknya partikel NaCl. NaCl adalah larutan elektrolit sehingga dapat diionkan menjadi ion positif dan negatif (terbentu 2 partikel).
Jadi, i = 2