
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2017 nomor 11 sampai dengan nomor 15 tentang:
- tata nama senyawa organik dan anorganik,
- hukum dasar kimia [hukum Dalton],
- hukum dasar kimia [hukum Proust],
- hukum dasar kimia [hukum Gay-Lussac], serta
- senyawa hidrokarbon.
Soal No. 11 tentang Tata Nama Senyawa Organik dan Anorganik
Tabel berikut menyatakan rumus dan nama senyawa.
Pasangan yang tepat antara rumus dan nama senyawanya adalah ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
| No. | Rumus Senyawa | Nama Senyawa |
| (1) | Al(OH)3 | Aluminium(III) hidroksida |
| (2) | Cr(OH)3 | Krom(III) hidroksida |
| (3) | Hg2Cl2 | Raksa(II) klorida |
| (4) | PbSO4 | Timbal(II) sulfat |
| (5) | ZnO | Seng(II) oksida |
Pasangan yang tepat antara rumus dan nama senyawanya adalah ….
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (5)
Pembahasan
Semua senyawa di atas tersusun dari unsur logam dan nonlogam. Logam yang hanya mempunyai satu bilangan oksidasi (semua logam golongan utama + Zn), penamaannya cukup dengan menyebut nama logam diikuti nama nonlogam dengan akhiran -ida.| Al(OH)3 | : | aluminium hidroksida |
| ZnO | : | seng oksida |
Akan tetapi jika unsur logam mempunyai lebih dari bilangan oksidasi, maka nama senyawa diberikan dengan menyebut nama logam + (huruf romawi biloks logam) + nama nonlogam dengan akhiran -ida.
| Cr(OH)3 | : | krom(III) klorida |
| Hg2Cl2 | : | raksa(1) klorida |
| PbSO4 | : | timbal(II) sulfat |
Jadi, pasangan yang tepat antara rumus dan nama senyawanya adalah 2 dan 4 (D).
Perdalam materi ini di Pembahasan Kimia UN: Tata Nama Senyawa Organik dan Anorganik.
Soal No. 12 tentang Hukum Dasar Kimia [Hukum Dalton]
Unsur belerang (S) dan unsur oksigen (O) dapat membentuk dua macam senyawa. Persentase unsur penyusun senyawa disajikan dalam tabel berikut.
Perbandingan massa unsur oksigen dalam dua senyawa tersebut sesuai Hukum Dalton adalah ….
A. 1 : 1
B. 1 : 2
C. 2 : 1
D. 2 : 3
E. 3 : 2
| Senyawa | Persentase | |
| S | O | |
| I | 50 | 0 |
| II | 40 | 60 |
Perbandingan massa unsur oksigen dalam dua senyawa tersebut sesuai Hukum Dalton adalah ….
A. 1 : 1
B. 1 : 2
C. 2 : 1
D. 2 : 3
E. 3 : 2

Pembahasan
John Dalton (1766 – 1844) merumuskan Hukum Kelipatan Perbandingan (Hukum Dalton) sebagai berikut:Jika dua jenis unsur bergabung membentuk lebih dari satu macam senyawa maka perbandingan massa unsur dalam senyawa-senyawa tersebut merupakan bilangan bulat sederhana.Perhatikan perbandingan persentase unsur S dan O pada senyawa I dan II berikut:
Senyawa I = 50 : 50 = 1 : 1 [dibagi 50]
Senyawa II = 40 : 60 = 1 : 3/2 [dibagi 40]
Sehingga perbandingan massa unsur O dalam senyawa I dan II adalah:
1 : 3/2 = 2 : 3 [masing-masing dikalikan 2]
Jadi, perbandingan massa unsur oksigen dalam dua senyawa tersebut sesuai Hukum Dalton adalah 2 : 3 (D).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 13 tentang Hukum Dasar Kimia [Hukum Proust]
Perhatikan tabel berikut ini!
Jika massa Pb yang digunakan sebanyak 25 g, massa S yang diperlukan sebanyak ….
A. 1 gram
B. 2 gram
C. 4 gram
D. 5 gram
E. 6 gram
| No. | Massa (gram) | ||
| Pb | S | PbS | |
| 1. | 10 | 1,6 | 11,6 |
| 2. | 15 | 15 | 17,4 |
| 3. | 30 | 4,8 | 34,8 |
Jika massa Pb yang digunakan sebanyak 25 g, massa S yang diperlukan sebanyak ….
A. 1 gram
B. 2 gram
C. 4 gram
D. 5 gram
E. 6 gram
Pembahasan
Tahun 1799 Joseph Proust merumuskan Hukum Perbandingan Tetap (Hukum Proust) yang berbunyi:Perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap.Berdasarkan hukum tersebut, mari kita cari pada tabel, reaksi mana penjumlah massa Pb dan S yang hasilnya sama dengan massa PbS. Ya, reaksi nomor 1 dan 3. Kita ambil saja reaksi nomor 1.
| Pb | : | S | : | PbS | |
| 10 | : | 1,6 | : | 11,6 | |
| 100 | : | 16 | : | 116 | [kali 10] |
| 25 | : | 4 | : | 29 | [bagi 4] |
Jadi, jika massa Pb yang digunakan sebanyak 25 gram, massa S yang diperlukan sebanyak 4 gram (C).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 14 tentang Hukum Dasar Kimia [Hukum Gay-Lussac]
Sebanyak 20 L campuran gas propana (C3H8) dan butena (C4H8) dibakar pada (T, P) sesuai persamaan:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
C4H8(g) + 6O2(g) → 4CO2(g) + 4H2O(l)
Volume gas CO2 setelah pembakaran adalah 68 L. Volume gas propana dan butena dalam campuran berturut-turut adalah ….
A. 8 L dan 12 L
B. 10 L dan 10 L
C. 12 L dan 8 L
D. 14 L dan 6 L
E. 16 L dan 4 L
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(l)
C4H8(g) + 6O2(g) → 4CO2(g) + 4H2O(l)
Volume gas CO2 setelah pembakaran adalah 68 L. Volume gas propana dan butena dalam campuran berturut-turut adalah ….
A. 8 L dan 12 L
B. 10 L dan 10 L
C. 12 L dan 8 L
D. 14 L dan 6 L
E. 16 L dan 4 L
Pembahasan
Pada tahun 1808 Joseph Louis Gay-Lussac (1778 –1850) mengemukakan Hukum Perbandingan Volume (Hukum Gay-Lussac) yang berbunyi:Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi merupakan bilangan bulat sederhana.Perbandingan volume tersebut setara dengan perbandingan koefisien masing-masing zat.
Volume 20 L merupakan volume campuran gas propana dan butena. Misal volume gas propana adalah x maka volume butena adalah 20 − x.
| C3H8(g) | + | 5O2(g) | → | 3CO2(g) | + | 4H2O(l) |
| x | 5x | 3x | 4x |
| C4H8(g) | + | 6O2(g) | → | 4CO2(g) | + | 4H2O(l) |
| 20 − x | 6(20 − x) | 4(20 − x) | 4(20 − x) |
Diketahui bahwa volume gas CO2 setelah pembakaran adalah 68 L. Artinya, volume gas CO2 hasil pembakaran propana dijumlah dengan volume gas CO2 hasil pembakaran butena sama dengan 68 L.
3x + 4(20 − x) = 68
3x + 80 − 4x = 68
80 − 68 = 4x − 3x
x = 12
Dengan demikian,
Volume C3H8 = x
= 12
Volume C4H8 = 20 − x
= 20 − 12
= 8
Jadi, volume gas propana dan butena dalam campuran berturut-turut adalah
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Soal No. 15 tentang Senyawa Hidrokarbon
Berikut ini grafik titik didih 3 buah isomer dari senyawa C5H12.

Berdasarkan grafik dapat diprediksi senyawa P, Q, dan R tersebut berturut-turut adalah ….

Berdasarkan grafik dapat diprediksi senyawa P, Q, dan R tersebut berturut-turut adalah ….
| P | Q | R | |
| A | n-pentana | 2-metilbutana | 2,2-dimetilpropana |
| B | n-pentana | 2,2-dimetilpropana | 2-metilbutana |
| C | 2-metilbutana | 2,2-dimetilpropana | n-pentana |
| D | 2,2-dimetilpropana | n-pentana | 2-metilbutana |
| E | 2,2-dimetilpropana | 2-metilbutana | n-pentana |
Pembahasan
Senyawa C5H12 adalah pentana dan isomernya, termasuk dalam golongan alkana. Alkana rantai lurus mempunyai titik didih lebih tinggi dibanding alkana rantai bercabang. Semakin banyak cabang, titik didih makin rendah.Mari kita perhatikan rumus struktur ketiga senyawa tersebut!
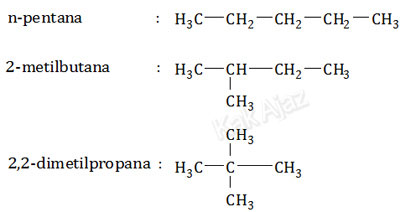
Berdasarkan rumus struktur di atas dapat disimpulkan bahwa:
- Senyawa P adalah 2,2-dimetilpropana karena cabangnya paling banyak sehingga titik didihnya paling rendah.
- Senyawa Q adalah 2-metilbutana karena cabangnya lebih sedikit sehingga titik didihnya lebih tinggi.
- Senyawa R adalah n-pentana karena rantainya lurus tak bercabang sehingga titik didihnya paling tinggi.
Simak Pembahasan Soal Kimia UN 2017 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

numpang nanya kak ajaz
ReplyDeletekalo 1-pentena dibandingkan dengan 2-pentena, mana yang lebih tinggi titik didihnya ?
makasih sebelumnya
Saya pakai konsep begini:
Delete"Titik didih masing alkena setara dengan titik didih alkana dengan jumlah atom C yang sama."
Mari kita analisis:
1. Bila 1-pentena dan 2-pentena masing-masing diadisi dengan hidrogen (hidrogenasi alkena) maka keduanya akan menghasilkan n-pentana.
2. Bila 1-pentena dan 2-pentena masing-masing diadisi dengan halogen (halogenasi alkena), misal Cl2, maka:
1-pentena akan menjadi 1,2-dikloro pentana (bisa dianggap 1 cabang)
2-pentena akan menjadi 2,3-dikloro pentana (2 cabang)
Dugaan:
Kemungkinan 1-pentena dan 2-pentena mempunyai titik didih yang sama. Kalaupun berbeda, 1-pentena mempunyai titik didih sedikit lebih tinggi
Permisi kak Jaz, untuk nomer 14 jika sesuai urutan propana kemudian butena maka jawabnya adalah (C) 12L dan 8L
ReplyDeleteOh, terbalik ya...!
DeleteTerima kasih Abdan Izza atas koreksinya. Kesalahan sudah saya perbaiki.
Makasih banyak kak atas bantuannya menjawab soal-soal UN! Alhamdulillah saya sangat terbantu dengan postingan kakak di blog kakak. Saya jadi bisa belajar sendiri di rumah, karena postingan kakak sangat jelas dan mudah untuk dipahami! Thank You kak, sukses terus yah!
ReplyDeleteAmin. Terima kasih kembali Tasya atas apresiasinya terhadap blog ini. Semoga lebih bersemangat belajar.
DeleteTerimakasih kak. Penjelasannya sangat jelas dan bermanfaat untuk belajar dirumah
ReplyDeleteTerima kasih kembali, Salma. Semoga berkah dan manfaat.
DeleteKak mau nanya pada nomor 18 kenapa nilainya pada ruas kanan tidak dimasukkan?
ReplyDeleteTerima kas8h
Maaf, nomor 18 yang mana ya? Pada postingan ini tidak ada nomor 18. Sedangkan nomor 18 pada postingan berikutnya adalah soal teori.
Deletekak jaz kalo senyawanya C6H12 itu gimana kak jaz
ReplyDeleteC6H12 itu golongan alkena (CnH2n)
DeleteCH2=CH-CH2-CH2-CH2-CH3
Permisi, kak. Nomor 11, bukankah Hg termasuk yg punya 2 biloks? Yaitu +1 dan +2?
ReplyDeletea. Hg^1+ = Hg2^2+ > Hg2Cl2 > raksa (I) klorida
b. Hg^2+ > HgCl2 > raksa (II) klorida
Terima kasih
Oh ya, betul sekali Adityaa. Terima kasih atas koreksinya. Kesalahan sudah saya perbaiki.
Delete