 |
| Kalorimeter |
Pembahasan soal Kimia Tes Kemampuan Dasar Sains dan Teknologi (TKD Saintek) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2017 Kode Naskah 157 nomor 36 sampai dengan nomor 40 tentang:
- energetika,
- unsur radioaktif,
- kesetimbangan kimia,
- sifat koligatif larutan, dan
- larutan penyangga.
Soal No. 36 tentang Energetika
Dalam kalorimeter sederhana (kapasitas kalornya diabaikan), sebanyak 3,27 g logam Zn direaksikan dengan HCl encer berlebih sehingga massa larutan menjadi 750 g (Mr HCl = 36,5; Ar Zn = 65,4). Kalor reaksi untuk 1 mol Zn adalah −240 kJ. Temperatur sistem kalorimeter meningkatkan dari 23,5 ℃ menjadi 27,5 ℃. Kalor jenis larutan yang terbentuk dalam J.g−1.℃−1 adalah ….
A. 1,5
B. 2,0
C. 4,0
D. 6,0
E. 8,0
A. 1,5
B. 2,0
C. 4,0
D. 6,0
E. 8,0
Pembahasan
Reaksi yang terjadi adalah sebagai berikut:Zn + 2HCl → ZnCl2 + H2 ∆H = −240 kJ/mol
Nilai mol dari Zn adalah:

Nilai mol dari larutan ZnCl2 besarnya sama dengan mol Zn karena koefisiennya sama.
mol ZnCl2 = mol Zn
= 0,05 mol
Larutan yang dihasilkan reaksi di atas, yaitu ZnCl2, mengandung kalor sebesar:
Q = mol × ∆H
= 0,05 × 240 kJ
= 12 kJ
= 12.000 J
Kalor sebesar itu digunakan untuk menaikkan suhu dari 23,5 ℃ menjadi 27,5 ℃ (∆t = 4 ℃).
Q = mc∆t
12.000 = 750 × c ×4
3000c = 12.000
c = 4
Jadi, kalor jenis larutan tersebut adalah 4,0 J.g−1.℃−1 (C).
Soal No. 37 tentang Unsur Radioaktif
Neptunium meluruh menjadi plutonium dengan memancarkan partikel β menurut reaksi orde satu sebagai berikut:
93Np239 → 94Pu239 + −1β0
Apabila 96 g 93Np239 meluruh sebanyak 90 g selama 12 hari, t1/2 dalam satuan hari adalah ….
A. 12
B. 9
C. 6
D. 4
E. 3
93Np239 → 94Pu239 + −1β0
Apabila 96 g 93Np239 meluruh sebanyak 90 g selama 12 hari, t1/2 dalam satuan hari adalah ….
A. 12
B. 9
C. 6
D. 4
E. 3

Pembahasan
Diketahui:N0 = 96 g
N = (96 − 90) g
= 6 g
t = 12 hari
Keterangan:
N adalah massa yang tersisa (massa awal dikurangi massa yang meluruh)
Peluruhan unsur radioaktif dirumuskan sebagai:

Nilai n adalah nilai perbandingan antara waktu peluruhan dan waktu paro.

Jadi, waktu paruh neptunium adalah 3 hari (E).
Soal No. 38 tentang Kesetimbangan Kimia
Gas SO3, SO2, dan O2 membentuk kesetimbangan berikut:
2SO3(g) ⇌ 2SO2(g) + O2(g)
Pada wadah 1 L dan temperatur tertentu, konsentrasi gas pada kesetimbangan masing-masing adalah 0,5 M. Kesetimbangan tersebut ….
A. tidak bergeser jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
B. bergeser ke kanan jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
C. bergeser ke kiri jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
D. tidak bergeser jika ke dalam wadah ditambahkan 1 mol SO3 dan 1 mol O2
E. bergeser ke kiri jika ke dalam wadah ditambahkan 1 mol SO3 dan 1 mol O2
2SO3(g) ⇌ 2SO2(g) + O2(g)
Pada wadah 1 L dan temperatur tertentu, konsentrasi gas pada kesetimbangan masing-masing adalah 0,5 M. Kesetimbangan tersebut ….
A. tidak bergeser jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
B. bergeser ke kanan jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
C. bergeser ke kiri jika ke dalam wadah ditambahkan SO3, SO2, dan O2 dengan jumlah mol yang sama
D. tidak bergeser jika ke dalam wadah ditambahkan 1 mol SO3 dan 1 mol O2
E. bergeser ke kiri jika ke dalam wadah ditambahkan 1 mol SO3 dan 1 mol O2
Pembahasan
Pergeseran reaksi karena penambahan konsentrasi dapat diketahui dari perubahan konstanta kesetimbangannya.Untuk reaksi:
2SO3(g) ⇌ 2SO2(g) + O2(g)
konstanta kesetimbangan konsentrasi (Kc) adalah:
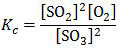
Reaksi di atas terjadi kesetimbangan saat konsentrasi masing-masing gas 0,5 M. Konstanta kesetimbangannya adalah:

Angka 0,5 ini kita jadikan patokan untuk menentukan pergeseran kesetimbangan. Jika setelah dilakukan penambahan konsentrasi:
- Kc > 0,5 → reaksi bergeser ke kiri
- Kc = 0,5 → reaksi tidak bergeser
- Kc < 0,5 → reaksi bergeser ke kanan
- Penambahan SO3, SO2, dan O2 dengan jumlah mol yang sama. Anggap saja masing gas ditambah 0,1 mol (= 0,1 M karena dalam wadah 1 L).
Karena diperoleh harga Kc > 0,5 maka reaksi bergeser ke kiri. [opsi A dan B salah, opsi C benar]
- Penambahan 1 mol SO3 dan 1 mol O2.
Karena diperoleh harga Kc < 0,5 maka reaksi bergeser ke kanan. [opsi D dan E salah]Jadi, pernyataan yang benar adalah opsi (C).
Soal No. 39 tentang Sifat Koligatif Larutan
Sebanyak 10 g elektrolit kuat AB2 yang dilarutkan dalam 1 L air pada 47 ℃ mempunyai tekanan osmosis 12,3 atm (R = 0,082 L.atm.mol−1.K−1), Mr AB2 adalah ….
A. 32
B. 64
C. 96
D. 128
E. 256
A. 32
B. 64
C. 96
D. 128
E. 256
Pembahasan
AB2 adalah elektrolit kuat, berarti senyawa tersebut dapat terionisasi sempurna.AB2 → A2+ + 2B−
AB2 terionisasi menjadi 3 partikel, yaitu 1 ion A2+ dan 2 ion B− sehingga faktor Van’t Hoff sama dengan jumlah partikel, i = 3.
Tekanan osmosis yang dialaminya dirumuskan sebagai:
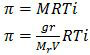
T adalah suhu mutlak (suhu dalam satuan Kelvin) , T = (47 + 273)K = 320 K. Sedangkan V adalah volume pelarut dalam satuan liter.
Berdasarkan rumus di atas, massa molekul relatif senyawa tersebut adalah:

Jadi, massa molekul relatif AB2 adalah 64 (B).
Soal No. 40 tentang Larutan Penyangga
Asam hipobromit (HOBr) adalah asam lemah dengan Ka = 10−9. Perbandingan [HOBr]/[OBr−] dalam larutan NaOBr pada pH = 10 adalah ….
A. 10−5
B. 10−4
C. 10−2
D. 10−1
E. 10
A. 10−5
B. 10−4
C. 10−2
D. 10−1
E. 10
Pembahasan
Diketahui:pH = 10
[H+] = 10−10
HOBr adalah asam lemah sedangkan OBr− adalah basa konjugasinya. Campuran keduanya akan membentuk larutan penyangga yang dirumuskan:

Garam yang dimaksud adalah NaOBr atau sama dengan basa OBr−. Sehingga perumusan di atas dapat ditulis:

Jadi, perbandingan antara asam lemah HOBr dan basa konjugasinya OBr− adalah 〖10〗^(-1) (D).
Simak Pembahasan Soal TKD Saintek SBMPTN 2017 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.


No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan