Soal tentang Asam dan Basa UN 2012
Perhatikan reaksi asam basa menurut Bronsted-Lowry berikut ini!
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
CH3COOH (aq) + HNO2 (aq) ⇌ CH3COOH2+ (aq) + NO2− (aq)
Spesi yang merupakan pasangan asam-basa konjugasi adalah ….
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
CH3COOH (aq) + HNO2 (aq) ⇌ CH3COOH2+ (aq) + NO2− (aq)
Spesi yang merupakan pasangan asam-basa konjugasi adalah ….
| A. | CH3COOH dengan HNO2 |
| B. | NH4+ dengan NH3 |
| C. | NH3 dengan H3O+ |
| D. | CH3COOH2+ dengan NO2− |
| E. | NH4+ dengan H2O |
Pembahasan
Secara sederhana, pasangan asam basa konjugasi dapat diartikan sebagai dua senyawa yang mempunyai susunan atom yang hampir sama tetapi mempunyai perbedaan jumlah atom H. Senyawa yang mempunyai jumlah atom H lebih banyak bertindak sebagai asam sedangkan yang mempunyai jumlah atom H lebih sedikit bertindak sebagai basa.Pada kedua reaksi di atas, yang bertindak sebagai asam basa konjugasi adalah:
- NH4+ dan NH3
- H3O+ dan H2O
- CH3COOH2+ dan CH3COOH
- HNO2 dan NO2−
Soal tentang Asam dan Basa UN 2013
Larutan 100 mL H2SO4 0,1 M mempunyai pH sebesar ….
| A. | 1 − log 2 |
| B. | 1 + log 1 |
| C. | 1 + log 2 |
| D. | 2 − log 2 |
| E. | 2 + log 1 |

Pembahasan
Asam sulfat, H2SO4, merupakan asam kuat sehingga untuk menentukan pH-nya menggunakan rumus:[H+] = a × Ma
dengan a adalah jumlah ion H+ dan Ma adalah molaritas asam atau konsentrasi asam dalam satuan molar.
Pada soal di atas diperoleh data:
| a | = | 2 |
| Ma | = | 0,1 M = 10−1 M |
Dengan demikian, pH asam sulfat tersebut adalah:
| [H+] | = | a × Ma |
| = | 2 × 10−1 | |
| pH | = | 1 − log 2 |
Jadi, pH larutan H2SO4 tersebut adalah 1 − log 2 (A).
Soal tentang Asam dan Basa UN 2015
Ke dalam 1.000 mL aquades dimasukkan padatan Ca(OH)2 sebanyak 3,7 gram lalu diaduk (penambahan volume Ca(OH)2 padat diabaikan). pH larutan setelah seluruh padatan terlarut adalah …. (Ar Ca = 40, O = 16, dan H = 1).
| A. | 1 + log 1 |
| B. | 2 − log 5 |
| C. | 12 + log 5 |
| D. | 13 + log 1 |
| E. | 13 − log 5 |
Pembahasan
Kalsium hidroksida atau Ca(OH)2 merupakan basa kuat. Nilai pH-nya dapat ditentukan melalui rumus:[OH−] = b × Mb
dengan b adalah jumlah ion OH− dan Mb adalah molaritas basa.
Nila b dan Mb pada soal di atas adalah:
b = 2
| Mr Ca(OH)2 | = | 40 + (16 + 1) × 2 |
| = | 40 + 34 | |
| = | 74 |
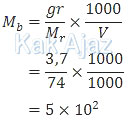
pH larutan Ca(OH)2 adalah:
| [OH−] | = | b × Mb |
| = | 2 × 5 × 10−2 | |
| = | 1 × 10−1 | |
| pOH | = | 1 − log 1 |
| pH | = | 14 − (1 − log 1) |
| = | 13 + log 1 |
Jadi, pH larutan kalsium hidroksida tersebut adalah 13 + log 1 (D).
Soal tentang Asam dan Basa UNAS 2010
Berdasarkan pengujian sampel air limbah diperoleh data sebagai berikut:
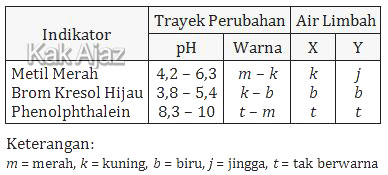
Harga pH sampel limbah X dan Y berturut-turut adalah ….

Harga pH sampel limbah X dan Y berturut-turut adalah ….
| A. | 6,3 ≤ pH ≤ 8,3 dan 5,4 ≤ pH ≤ 6,3 |
| B. | 6,3 ≤ pH ≤ 8,3 dan 4,2 ≤ pH ≤ 6,3 |
| C. | pH ≤ 8,3 dan 4,2 ≤ pH ≤ 6,3 |
| D. | pH ≤ 4,2 dan 4,2 ≤ pH ≤ 6,3 |
| E. | pH ≥ 8,3 dan pH ≤ 6,3 |
Pembahasan
Trayek pH untuk air limbah X| skala m - k menunjuk k | → | pH ≥ 6,3 |
| skala k - b menunjuk b | → | pH ≥ 5,4 |
| skala t - m menunjuk t | → | pH ≤ 8,3 |
| 6,3 ≤ pH ≤ 8,3 | ||
Trayek pH untuk air limbah Y
| m - k menunjuk j | → | 4,2 ≤ pH ≤ 6,3 |
| k - b menunjuk b | → | pH ≥ 5,4 |
| t - m menunjuk t | → | pH ≤ 8,3 |
| 5,4 ≤ pH ≤ 6,3 | ||
Jika masih bingung dengan keterangan di atas, coba kita gunakan garis bilangan yang biasanya dipakai dalam matematika.
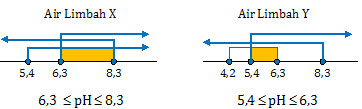
Jadi, harga pH sampel X dan Y berturut-turut adalah opsi (A).
Soal tentang Asam dan Basa UN 2011
Berikut data hasil titrasi larutan HCl dengan larutan NaOH 0,1 M.
Berdasarkan data tersebut, konsentrasi larutan HCl adalah ….
| Percobaan | Volume HCl yang dititrasi | Volume NaOH yang dititrasi |
| 1 2 3 | 20 mL 20 mL 20 mL | 15 mL 14 mL 16 mL |
Berdasarkan data tersebut, konsentrasi larutan HCl adalah ….
| A. | 0,070 M |
| B. | 0,075 M |
| C. | 0,080 M |
| D. | 0,133 M |
| E. | 0,143 M |
Pembahasan
Data-data yang dapat diperoleh dari soal di atas adalah:Molaritas NaOH:
M1 = 0,1 M
Volume NaOH:
| V1 | = | ⅓ (15 + 14 +16) mL |
| = | ⅓ × 45 mL | |
| = | 15 mL |
Volume HCl:
| V2 | = | ⅓ (20 + 20 +20) mL |
| = | 20 mL |
Molaritas HCl: M2 = ?
Titik titrasi terjadi saat mol NaOH sama dengan mol HCl.
| mol1 | = | mol2 |
| M1 × V1 | = | M2 × V2 |
| 0,1 × 15 | = | M2 × 20 |
| M2 | = | 1,5 : 20 |
| = | 0,075 |
Jadi, konsentrasi larutan asam klorida tersebut adalah 0,075 M (B).
Pembahasan soal Asam dan Basa lainnya bisa dilihat di:
Pembahasan Kimia UN 2014 No. 9
Pembahasan Kimia UN 2015 No. 10
Pembahasan Kimia UN 2015 No. 12
Pembahasan Kimia UN 2016 No. 11 - 12.
Pembahasan Kimia UN 2017 No. 22 - 24
Pembahasan Kimia UN 2018 No. 7 - 8
Pembahasan Kimia UN 2018 No. 12
Pembahasan Kimia UN 2019 No. 27 dan 28
Pembahasan Kimia UN 2019 No. 33
Simak juga, Pembahasan Kimia UN: Stoikiometri Larutan.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan