Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 31 sampai dengan nomor 35 tentang:
- hidrolisis garam,
- larutan penyangga,
- larutan asam dan basa,
- minyak bumi, dan
- karbohidrat.
Soal No. 31 tentang Hidrolisis Garam
Seorang petani kebingungan karena lahannya sudah kurang produktif lagi dibandingkan sebelumnya setelah terdampak hujan asam letusan gunung berapi. Padahal secara rutin ia telah menambahkan pupuk nitrogen dan amonia dengan maksud menyuburkan lahannya. Setelah pH tanah diperiksa, ternyata diperoleh pH sebesar 2. Menurut pandangan ahli, penggunaan pupuk nitrogen berlebihan, justru menyebabkan pH tanah menjadi asam disebabkan bakteri dalam tanah mengoksidasi ion NH4+ menjadi nitrat, NO3−.
Dari beberapa zat berikut:
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Dari beberapa zat berikut:
- K2HPO4
- NH4NO3
- CaCO3 (kapur)
- CO(NH2)2
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Zat-zat yang disebutkan pada soal di atas kebanyakan adalah senyawa garam. Karena pH tanahnya sangat asam maka harus ditambahkan garam yang bersifat basa. Mari kita periksa garam-garam di atas satu per satu!- K2HPO4 berasal dari basa kuat KOH dan asam lemah H3PO4 sehingga bersifat basa [nomor 1 benar]
- NH4NO3 berasal dari basa lemah NH4OH dan asam kuat HO3 sehingga bersifat asam [nomor 2 salah]
- CaCO3 berasal dari basa kuat Ca(OH)2 dan asam lemah H2CO3 sehingga bersifat basa [nomor 3 benar]
- CO(NH2)2 : pupuk urea, bersifat basa lemah [nomor 4 salah]
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Soal No. 32 tentang Larutan Penyangga
Serang siswa mencoba membuat larutan penyangga dengan pH = 5 dari zat-zat yang tersedia yaitu larutan CH3COOH 1 M (Ka CH3COOH = 1 × 10−5) dan kristal NaCH3COO (Mr = 82).
Langkah-langkah yang dilakukan:
Langkah-langkah yang dilakukan:
- Menimbang 8,2 gram NaCH3COO kemudian menambahkannya dengan 100 mL air. Selanjutnya diaduk hingga larut.
- Mengukur 200 mL larutan CH3COOH kemudian memasukkannya ke dalam gelas kimia yang berisi larutan NaCH3COO.
- Mengaduknya hingga campuran larutan menjadi homogen.
| A. | pada tahap I, bukan ditambah dengan 100 mL, melainkan ditambahkan air hingga volume larutan menjadi 100 mL |
| B. | kristal NaCH3COO seharusnya dilarutkan terlebih dahulu |
| C. | volume CH3COOH yang ditambahkan terlalu banyak |
| D. | zat yang ditambahkan pada prosedur 2 seharusnya bukan CH3COOH melainkan garam CH3COONa |
| E. | garam NaCH3COO dilarutkan dalam air melainkan langsung dilarutkan dalam CH3COOH |
Pembahasan
Coba Kak Ajaz hitung dulu pH dari larutan penyangga yang dihasilkan berdasarkan prosedur yang dilakukan oleh siswa tersebut.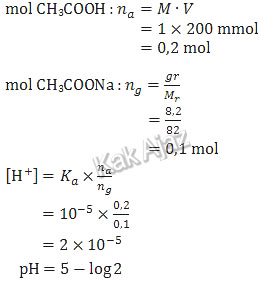
Ya, pH yang dihasilkan memang kurang dari 5. Kalau diperhatikan rumusnya, mol asam (na = MV) terlalu besar. Kalau saja volume CH3COOH yang digunakan 100 mL maka pH yang dihasilkan akan tepat sama dengan 5.
Jadi, tahapan yang menyimpang dalam pembuatan penyangga tersebut adalah volume CH3COOH yang ditambahkan terlalu banyak (C).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga.
Soal No. 33 tentang Larutan Asam dan Basa
Berikut adalah gambar 2 buah larutan basa yang memberikan warna sama dengan indikator fenolftalein.
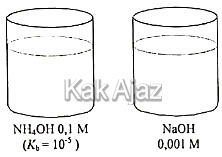
Pernyataan yang benar terkait dengan kedua larutan basa tersebut adalah ….

Pernyataan yang benar terkait dengan kedua larutan basa tersebut adalah ….
| A. | harga pH kedua larutan tersebut adalah 11 |
| B. | dengan indikator fenolftalein larutan tidak berwarna |
| C. | konsentrasi NH4OH sama dengan konsentrasi NaOH |
| D. | dibutuhkan konsentrasi asam yang tidak sama untuk menetralkan kedua basa |
| E. | konsentrasi ion OH− dari NH4OH > konsentrasi ion OH- dari NaOH |

Pembahasan
NH4OH adalah basa lemah, cirinya terdapat harga Kb. Nilai pH basa lemah dapat ditentukan dengan rumus:[OH−] = √(Kb ∙ M)
= √(10−5 × 10−1)
= 10−3
pOH = 3
pH = 14 − 3
= 11
Sedangkan NaOH adalah basa kuat. Nilai pH basa kuat dirumuskan sebagai:
[OH−] = a ∙ M
= 1 × 10−3
pOH = 3
pH = 11
∴ pH kedua larutan tersebut adalah sama. [opsi A benar]
Sekarang Kak Ajaz yakinkan bahwa keempat opsi yang lain salah.
- Pada pH = 11 indikator fenolftalein masih menunjukkan warna meski mulai memudar. [opsi B salah]
- Konsentrasi kedua larutan tertera pada gambar, [NH4OH] = 0,1 M dan [NaOH] = 0,001 M. [opsi C salah]
- Kedua larutan mempunyai pH yang sama, berarti konsentrasi basa [OH−] juga sama sehingga untuk menetralkan dibutuhkan konsentrasi asam [H+] yang sama. [opsi D dan E salah]
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 34 tentang Minyak Bumi
Mesin kendaraan bermotor dapat bekerja karena adanya energi hasil pembakaran bensin dengan gas oksigen. Bensin mengandung campuran hidrokarbon rantai lurus (n-heptana) maupun rantai bercabang (isooktana). Berikut ini disajikan data beberapa bahan bakar dengan kandungan hidrokarbon bercabang.
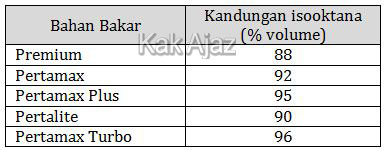
Bahan bakar yang memiliki mutu terbaik adalah ….
A. Pertamax Turbo
B. Pertamax Plus
C. Pertamax
D. Pertalite
E. Premium

Bahan bakar yang memiliki mutu terbaik adalah ….
A. Pertamax Turbo
B. Pertamax Plus
C. Pertamax
D. Pertalite
E. Premium
Pembahasan
Kandungan isooktana atau bilangan oktan adalah angka yang menunjukkan besar tekanan sebelum bahan bakar dibakar secara spontan. Semakin tinggi bilangan oktan semakin baik mutu suatu bahan bakar.Jadi, bahan bakar yang memiliki mutu terbaik adalah pertamax turbo (A).
Soal No. 35 tentang Karbohidrat
Berikut ini hasil uji karbohidrat.
A. glukosa
B. fruktosa
C. sukrosa
D. amilum
E. selulosa
- Menghasilkan endapan ungu dengan pereaksi Molisch.
- Menghasilkan warna biru jika ditambah larutan iodin.
- Ditambah pereaksi Fehling tidak menghasilkan endapan merah bata.
A. glukosa
B. fruktosa
C. sukrosa
D. amilum
E. selulosa
Pembahasan
Uji Molisch digunakan untuk menunjukkan adanya karbohidrat. Reaksi positif ditunjukkan dengan adanya endapan merah-ungu. → semua opsiUji Fehling digunakan untuk menunjukkan adanya gula pereduksi (fruktosa, glukosa, maltosa, dan laktosa). Reaksi positif ditunjukkan dengan adanya endapan Cu2O yang berwarna merah bata. Jika bereaksi negatif berarti bahan uji adalah sukrosa, amilum, atau selulosa. → amilum atau selulosa
Uji Iodin pada karbohidrat adalah untuk mengidentifikasi adanya polisakarida. Biru-ungu untuk amilum, cokelat merah untuk glikogen, dan cokelat untuk selulosa. → amilum
Jadi, golongan karbohidrat tersebut adalah amilum (D).
Perdalam materi ini di Pembahasan Kimia UN: Karbohidrat dan Protein.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

terima kasih 😉
ReplyDeleteSama-sama. Semoga berkah dan manfaat
DeleteMakasih banyak:)
ReplyDeleteTerima kasih kembali. Semoga bermanfaat
DeleteTerima kasih kak
ReplyDeleteSama-sama. Semoga berkah dan manfaat
Delete