
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2018 nomor 6 sampai dengan nomor 10 tentang:
- larutan elektrolit dan nonelektrolit,
- titrasi asam basa,
- larutan asam basa,
- larutan penyangga, serta
- penerapan larutan penyangga.
Soal No. 6 tentang Larutan elektrolit dan Nonelektrolit
Perhatikan data hasil uji daya hantar listrik terhadap beberapa larutan berikut!
Berdasarkan data tersebut, pasangan larutan yang memiliki derajat ionisasi = 0 ditunjukkan pada nomor ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (4)
D. (3) dan (5)
E. (4) dan (5)
| Larutan | Lampu | Gelembung pada Elektroda | |||
| Nyala | Mati | Banyak | Sedikit | Tidak Ada | |
| (1) | − | ✓ | − | − | ✓ |
| (2) | − | ✓ | − | − | ✓ |
| (3) | ✓ | − | ✓ | − | − |
| (4) | − | ✓ | − | ✓ | − |
| (5) | − | ✓ | − | ✓ | − |
Berdasarkan data tersebut, pasangan larutan yang memiliki derajat ionisasi = 0 ditunjukkan pada nomor ….
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (4)
D. (3) dan (5)
E. (4) dan (5)
Pembahasan
Berikut ini tabel hubungan antara jenis larutan dengan derajat ionisasi, adanya gelembung, dan nyala lampu.| Larutan | Derajat Ionisasi | Gelembung | Nyala Lampu |
| Elektrolit Kuat | α = 1 | banyak | terang |
| Elektrolit Lemah | 0 < α < 1 | sedikit | redup |
| Nonelektrolit | α = 0 | tidak ada | mati |
Dengan demikian, larutan yang mempunyai derajat ionisasi = 0 adalah larutan nonelektrolit dengan indikasi lampu mati dan tidak ada gelembung.
Jadi, pasangan larutan yang memiliki derajat ionisasi = 0 ditunjukkan pada nomor 1 dan 2 (A).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Elektrolit dan Nonelektrolit
Soal No. 7 tentang Titrasi Asam Basa
Perhatikan data titrasi asam basa berikut!
Kadar (%) massa H2SO4 (Mr = 98 g.mol−1) yang terdapat dalam 20 mL larutan asam sulfat tersebut jika massa jenisnya 1,8 gram/mL adalah ….
A. 0,32%
B. 0,49%
C. 0,98%
D. 1,30%
E. 4,90%
| No. | Volume Larutan (mL) | |
| H2SO4 x M | NaOH 0,4 M | |
| (1) | 20 | 24,0 |
| (2) | 20 | 23,8 |
| (3) | 20 | 24,2 |
Kadar (%) massa H2SO4 (Mr = 98 g.mol−1) yang terdapat dalam 20 mL larutan asam sulfat tersebut jika massa jenisnya 1,8 gram/mL adalah ….
A. 0,32%
B. 0,49%
C. 0,98%
D. 1,30%
E. 4,90%

Pembahasan
Massa H2SO4 mula-mula sebelum titrasi adalah:m = ρV
= 1,8 ∙ 20 gram
= 36 gram
Saat titrasi asam basa, berlaku hubungan:
M1 V1 a = M2 V2 b
dengan a dan b berturut-turut adalah jumlah ion H+ dan OH− sedangkan V adalah volume rata-rata pada tabel percobaan di atas.
M1 ∙ 20 ∙ 2 = 0,4 ∙ 24 ∙ 1
M1 = 0,24
Kemudian nilai molar ini kita jabarkan lagi untuk mendapat massa H2SO4 sesudah titrasi.

Dengan demikian, persentase massa H2SO4 adalah:
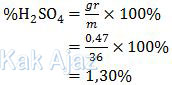
Jadi, kadar H2SO4 tersebut adalah 1,30% (D).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa
Soal No. 8 tentang Larutan Asam Basa
Perhatikan gambar dua larutan berikut ini!
Pernyataan terkait kedua larutan tersebut, antara lain:
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)
Pernyataan terkait kedua larutan tersebut, antara lain:
- Kedua larutan sama-sama memiliki pH = 3.
- Kedua larutan adalah asam lemah.
- Kedua larutan memiliki harga [H+] yang sama.
- Kedua larutan dapat mengubah warna lakmus merah.
- Kedua larutan dapat terionisasi sempurna.
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)
Pembahasan
Berikut ini penjelasan tentang kedua gambar di atas.- HCl adalah asam kuat sedangkan CH3COOH adalah asam lemah. CH3COOH dikatakan asam lemah karena tercantum nilai Ka pada gambar di atas. [pernyataan 2 salah]
- Asam kuat akan terionisasi sempurna sedangkan asam lemah akan terionisasi sebagian. [pernyataan 5 salah]
- Karena kedua larutan merupakan larutan asam maka dapat kedua larutan memerahkan lakmus biru. Sedangkan lakmus merah tetap merah. [pernyataan 4 salah]
- Nilai keasaman dari kedua larutan adalah:
HCl → [H+] = a M
= 1 × 10−3
= 10−3
pH = 3
CH3COOH → [H+] = √(Ka M)
= √(10−5 ∙ 10−1)
= 10−3
pH = 3
Kedua larutan tersebut mempunyai harga [H+] dan pH yang sama. [pernyataan 1 dan 3 benar]Jadi, penjelasan yang tepat mengenai kedua larutan tersebut nomor adalah penjelasan 1 dan 3 (A).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa
Soal No. 9 tentang Larutan Penyangga
Diketahui campuran larutan penyangga sebagai berikut.
Urutan harga pH dimulai dari yang terkecil adalah ….
A. (1) – (2) – (3)
B. (1) – (3) – (2)
C. (2) – (1) – (3)
D. (3) – (1) – (2)
E. (3) – (2) – (1)
| No. | Larutan Asam | Larutan Garam | Ka/Kb |
| (1) | 50 mL CH3COOH 0,1 M | 50 mL CH3COONa 0,1 M | 10−5 |
| (2) | 50 mL CH3COOH 0,1 M | 100 mL CH3COONa 0,1 M | 10−5 |
| (3) | 50 mL CH3COOH 0,2 M | 50 mL KCN 0,1 N | 2 × 10−5 |
Urutan harga pH dimulai dari yang terkecil adalah ….
A. (1) – (2) – (3)
B. (1) – (3) – (2)
C. (2) – (1) – (3)
D. (3) – (1) – (2)
E. (3) – (2) – (1)
Pembahasan
Kita hitung satu per satu ya!Nomor (1)
mol asam = 50 mL × 0,1 M = 5 mmol
mol garam = 50 mL × 0,1 M = 5 mmol
[H+] = Ka × na/ng
= 10−5 × 5/5
= 10−5
pH = 5
Nomor (2)
mol asam = 50 mL × 0,1 M = 5 mmol
mol garam = 100 mL × 0,1 M = 10 mmol
[H+] = Ka × na/ng
= 10−5 × 5/10
= 5 × 10−6
pH = 6 – log 5
Nomor (3)
Campuran larutan nomor (3) tidak membentuk larutan penyangga karena KCN bukan garam dari asam lemah CH3COOH. Oleh karena itu pH campuran hanya dihitung berdasarkan rumus pH asam lemah.
[H+] = √(Ka M)
= √(2 × 10−5 ∙ 2 × 10−1)
= √(4 × 10−6)
= 2 × 10−3
pH = 3 – log 2
Jadi, urutan harga pH dimulai dari yang terkecil adalah 3 – 1 – 2 (D).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga
Soal No. 10 tentang Penerapan Larutan Penyangga
Bacalah wacana berikut!
Berdasarkan wacana tersebut, pemberian larutan bikarbonat pH 6,7 bertujuan untuk ….
A. menaikkan pH darah dengan menggeser kesetimbangan ke arah kiri
B. menaikkan pH darah dengan menggeser kesetimbangan ke arah kanan
C. menaikkan pH darah tanpa menggeser kesetimbangan
D. menurunkan pH darah dengan menggeser kesetimbangan ke arah kiri
E. menurunkan pH darah dengan menggeser kesetimbangan ke arah kanan
pH normal darah manusia sudah dirancang selalu relatif tetap 7,40 ± 0,05. Komponen utama buffer darah adalah H2CO3 – HCO3− dengan perbandingan 1 : 20 yang merupakan salah satu hasil metabolisme pernapasan.
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(l) ⇌ H2CO3(aq)
H2CO3(aq) + H2O(l) ⇌ H3O+(aq) + HCO3−(aq) Ka1 = 4,3 × 0−7
Pada kasus alkalosis atau kelebihan basa yang disebabkan berkurangnya CO2 terlarut, pH darah naik hingga mencapai 7,8. Jika dibiarkan akan menyebabkan kerusakan sistem saraf. Salah satu upaya mengembalikan pH normal darah adalah dengan pemberian masker gas oksigen didukung infus larutan buffer bikarbonat pH 6,7 selama selang waktu tertentu.
CO2(g) ⇌ CO2(aq)
CO2(aq) + H2O(l) ⇌ H2CO3(aq)
H2CO3(aq) + H2O(l) ⇌ H3O+(aq) + HCO3−(aq) Ka1 = 4,3 × 0−7
Pada kasus alkalosis atau kelebihan basa yang disebabkan berkurangnya CO2 terlarut, pH darah naik hingga mencapai 7,8. Jika dibiarkan akan menyebabkan kerusakan sistem saraf. Salah satu upaya mengembalikan pH normal darah adalah dengan pemberian masker gas oksigen didukung infus larutan buffer bikarbonat pH 6,7 selama selang waktu tertentu.
Berdasarkan wacana tersebut, pemberian larutan bikarbonat pH 6,7 bertujuan untuk ….
A. menaikkan pH darah dengan menggeser kesetimbangan ke arah kiri
B. menaikkan pH darah dengan menggeser kesetimbangan ke arah kanan
C. menaikkan pH darah tanpa menggeser kesetimbangan
D. menurunkan pH darah dengan menggeser kesetimbangan ke arah kiri
E. menurunkan pH darah dengan menggeser kesetimbangan ke arah kanan
Pembahasan
Penambahan buffer bikarbonat (HCO3−) berarti menambah konsentrasi HCO3− di ruas kanan (perhatikan reaksi 3 pada wacana di atas). Akibatnya, reaksi bergeser ke kiri sehingga terjadi penurunan pH.Jadi, pemberian larutan bikarbonat pH 6,7 bertujuan untuk menurunkan pH darah dengan menggeser kesetimbangan ke arah kiri (D).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga
Simak Pembahasan Soal Kimia UN 2018 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.


kakak mau tanya jawaban seterusnya mana dari 11-40? mohon bantuannya no 11-40 soal un kimia 2018
ReplyDeleteDitunggu ya, Ricky. Semua akan Kak Ajaz bahas
DeleteThanks banget ka,sangat bermanfaat
ReplyDeleteSama-sama, Mita. Semoga berkah
DeleteMakasih kak
ReplyDeleteSama-Sama, Sylvia.
DeleteSangat bermanfaat....mkasih kak
ReplyDeleteTerima kasih kembali. Semoga berkah
DeleteSangat bermanfaat kak ajaz, terima kasih kak :)
ReplyDeleteSama-sama. Semoga berkah
DeletePembahasan 1- 40 kak sudah ada ?
ReplyDeleteIni sangat membantu sekalii
Sudah, tiap artikel memang 5 soal.
DeleteTerima kasih kembali, Reza
Trimah kasih atas bantuannya kak_
ReplyDeleteSama-sama. Semoga berkah dan manfaat
DeleteTerimakasih banyak, Kak Ajaz. Sangat membantu dalam mengerjakan soal-soal UN. Semoga rezeki Kak Ajaz bertambah. Makasih, lagi, ya Kak! GBU.
ReplyDeleteAmin. Terima kasih atas atensinya, semoga berkah dan manfaat
DeleteSangat membantu kak blognya 👍 kebetulan aku mau un kimia, mau nanya kak kalo pembahasan soal un kimianya cmn adanya
ReplyDelete1 paket aja ya kak?
Untuk sementara ini hanya 1 paket, kalau ada waktu senggang akan kak ajaz bahas juga paket yang lain.
DeleteTerima kasih juga, Mela. Semoga sukses menghadapi UN Kimia
Terima kasihhh bangett semoga berkah ilmunya aamiin
ReplyDeleteAmin. Terima kasih kembali, Ijimeru. Semoga berkah dan manfaat
Delete