- larutan penyangga,
- hidrolisis garam,
- kelarutan dan hasil kali kelarutan,
- sifat koligatif larutan,
- serta sistem koloid.
Soal No. 11 tentang Larutan Penyangga
Berikut ini merupakan senyawa/ion yang dapat bersifat larutan penyangga.
- CH3COOH dan CH3COO−
- NH3 dan NH4+
- HCOOH dan HCOO−
- H2CO3 dan HCO3−
- C5H7O4CO2H dan C5H7O4CO2−
A. (1)
B. (2)
C. (3)
D. (4)
E. (5)
Pembahasan
Larutan penyangga alami yang terdapat dalam cairan ekstrasel makhluk hidup adalah penyangga karbonat, yaitu H2CO3 dan HCO3−. Larutan penyangga ini berfungsi untuk mempertahankan pH darah sekitar 7,4. pH darah tidak boleh turun di bawah 7,0 atau naik di atas 7,8.Jadi opsi jawaban yang benar adalah (D).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Penyangga.
Soal No. 12 tentang Hidrolisis Garam
Larutan 25 ml CH3COOH 0,2 M direaksikan dengan 25 ml NaOH 0,2 M sesuai reaksi:
CH3COOH (aq) + NaOH (aq) → CH3CONa (aq) + H2O (l)
Jika Ka CH3COOH = 10−5 maka pH larutan yang terbentuk adalah ....
A. 5 − log 2
B. 7 + log 1
C. 9 + log 1
D. 13 − log 2
E. 13 + log 2
CH3COOH (aq) + NaOH (aq) → CH3CONa (aq) + H2O (l)
Jika Ka CH3COOH = 10−5 maka pH larutan yang terbentuk adalah ....
A. 5 − log 2
B. 7 + log 1
C. 9 + log 1
D. 13 − log 2
E. 13 + log 2

Pembahasan
Kita periksa dulu jumlah mol asam dan basanya.mol CH3COOH = 25 ml × 0,2 M
= 5 mmol
mol NaOH = 25 ml × 0,2 M
= 5 mmol
Karena mol CH3COOH sama dengan mol NaOH maka pada reaksi tersebut terjadi hidrolisis garam. Mol garam juga sama dengan 5 mmol karena perbandingan koefisiennya sama. Sedangkan volumenya merupakan volume campuran (25 ml + 25 ml = 50 ml) karena garam tersebut terhidrolisis dalam air. Sehingga konsentrasi molar garam tersebut adalah:
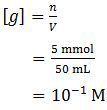
Hidrolisis garam tersebut berasal dari asam lemah dan basa kuat sehingga garamnya bersifat basa. Dengan demikian rumus hidrolisisnya adalah:

Jadi, pH larutan yang terbentuk adalah 9 + log 1 (C).
Perdalam materi ini di Pembahasan Kimia UN: Hidrolisis Garam.
Soal No. 13 tentang Kelarutan dan Hasil Kali Kelarutan
100 ml NaOH 0,008 M direaksikan dengan 100 ml CH3COOH 0,008 M. Ke dalam larutan reaksi ditetesi larutan encer CaCl2 dan penetesan diakhiri ketika di larutan tepat jenuh atau tepat Ca(OH)2 akan mengendap. Kalau Kw = 10−14, Ksp Ca(OH)2 = 4 × 10−16, dan Ka = 10−5 maka [Ca2+] pada saat tepat jenuh adalah ....
A. 10−1 M
B. 10−2 M
C. 10−3 M
D. 10−4 M
E. 10−5 M
A. 10−1 M
B. 10−2 M
C. 10−3 M
D. 10−4 M
E. 10−5 M
Pembahasan
Mula-mula akan terjadi hidrolisis garam dengan konsentrasi garam: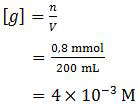
Hidrolisis garam tersebut bersifat basa sehingga dapat diperoleh:

Tepat saat Ca(OH)2 akan mengendap, berlaku:
Ca(OH)2 → Ca2+ + 2 OH−
Ksp Ca(OH)2 = [Ca2+] . [OH−]2
4 × 10-16 = [Ca2+] . (2 × 10−6)2
[Ca2+] = 10−4
Jadi, konsentrasi Ca2+ pada saat tepat jenuh adalah 10−4 M (D).
Perdalam materi ini di Pembahasan Kimia UN: Kelarutan dan Hasil Kali Kelarutan.
Soal No. 14 tentang Sifat Koligatif Larutan
Berikut ini peristiwa kimia dalam kehidupan sehari-hari:
A. penurunan tekanan uap dan tekanan osmotik
B. tekanan osmotik dan kenaikan titik didih
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan osmosis balik
E. penurunan titik beku dan kenaikan titik didih
- etilen glikol dapat ditambahkan ke dalam radiator mobil, dan
- desalinasi air laut.
A. penurunan tekanan uap dan tekanan osmotik
B. tekanan osmotik dan kenaikan titik didih
C. kenaikan titik didih dan penurunan titik beku
D. penurunan titik beku dan osmosis balik
E. penurunan titik beku dan kenaikan titik didih
Pembahasan
Di daerah yang beriklim dingin, air radiator mudah membeku. Untuk mengatasinya, ke dalam air radiator biasanya ditambahkan etilen glikol. Etilen glikol ini berfungsi untuk menurunkan titik beku. Sehingga pada suhu yang dingin, air radiator campuran ini belum membeku karena titik bekunya sudah turun.Desalinisasi air laut adalah proses pembuatan air murni dari air laut. Mula-mula air laut dipisahkan dengan membran semipermeabel. Dengan memberi tekanan yang cukup, partikel air pada air laut akan mampu menembus membran. Sementara itu, partikel-partikel lain yang terkandung dalam air laut akan tertahan. Proses ini disebut osmosis balik.
Jadi, penambahan etilen glikol dan desalinisasi air laut berhubungan dengan penurunan titik beku dan osmosis balik (D).
Perdalam materi ini di Pembahasan Kimia UN: Sifat Koligatif Larutan.
Soal No. 15 tentang Sistem Koloid
Beberapa contoh penerapan sifat koloid dalam kehidupan sehari-hari.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
- Terjadinya delta di muara sungai.
- Penggunaan obat norit pada diare.
- Peristiwa cuci darah.
- Penjernihan air.
- Sorot lampu di malam hari.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (3) dan (4)
E. (4) dan (5)
Pembahasan
Penerapan sifat koloid dalam kehidupan sehari-hari antara lain:Efek Tyndall
Efek Tyndall adalah peristiwa penghamburan cahaya oleh partikel-partikel koloid. Contoh dalam kehidupan sehari-hari adalah:- langit berwarna biru pada siang hari dan berwarna jingga pada sore hari,
- sorot lampu pada udara yang berkabut, dan
- sinar matahari melalui celah-celah daun pada pagi yang berkabut.
Elektroforesis
Elektroforesis adalah pergerakan partikel koloid yang bermuatan karena pengaruh medan listrik. Dalam kehidupan sehari-hari, elektroforesis diterapkan untuk:- identifikasi DNA,
- mendeteksi kelainan genetik, dan
- penyaringan debu pabrik (Cottrell).
Adsorpsi
Adsorpsi adalah penyerapan partikel bermuatan oleh permukaan-permukaan koloid. Sifat adsorpsi ini biasanya diterapkan untuk:- pemutihan gula pasir,
- penyembuhan diare dengan norit,
- penjernihan air dengan tawas,
- pewarnaan serat wol, dan
- bahan aktif deodorant.
Koagulasi
Koagulasi adalah proses penggumpalan atau pengendapan partikel-partikel koloid. Penerapan koagulasi dalam kehidupan sehari-hari antara lain:- penjernihan air,
- pengolahan karet dari lateks,
- pembuatan tahu,
- penggumpalan debu atau asap pabrik, dan
- pembentukan delta di muara sungai.
Koloid Pelindung
Koloid pelindung adalah koloid yang dapat melindungi koloid lain agar stabil, misal tidak mengalami koagulasi. Contoh penerapannya adalah:- penambahan kasein pada susu,
- penambahan lisitin pada margarin,
- penambahan gelatin pada es krim, dan
- penambahan minyak silikon pada cat.
Dialisis
Dialisis adalah proses pemisahan koloid dengan larutan sejati melalui membran semipermeabel. Penerapan sifat koloid ini dalam kehidupan sehari-hari adalah:- proses cuci darah pada pasien gagal ginjal dan
- pemisahan ion sianida dari tepung tapioka.
Perdalam materi ini di Pembahasan Kimia UN: Sistem Koloid.
Simak Pembahasan Soal Kimia UN 2014 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan