- polimer,
- termokimia (reaksi eksoterm),
- laju reaksi,
- termokimia (entalpi reaksi), dan
- kesetimbangan kimia.
Soal No. 26 tentang Polimer
Dua jenis monomer, yaitu asam adipat dan heksametilendiamina.

Reaksi dua jenis monomer tersebut akan dihasilkan ....


Reaksi dua jenis monomer tersebut akan dihasilkan ....

Pembahasan
Polimerisasi antara asam adipat (asam heksanadioat) dengan heksametilendiamina (diaminoheksana) termasuk polimerisasi kondensasi. Ciri polimerisasi kondensasi adalah:- monomernya tidak sejenis,
- monomernya mempunyai gugus fungsional pada kedua ujung rantainya, dan
- dihasilkan senyawa selain polimer dengan struktur yang lebih sederhana.

Reaksi polimerisasi tersebut adalah polimerisasi nilon 66. Pada polimerisasi tersebut, gugus −OH pada kedua ujung rantai asam adipat akan lepas. Demikian juga salah satu atom H pada kedua ujung rantai heksametilendiamina. Induk asam adipat dan induk heksametilendiamina membentuk nilon 66. Sedangkan gugus −OH dan atom H membentuk air.
Jadi, reaksi dua jenis monomer tersebut akan dihasilkan nilon 66 (A).
Perdalam materi ini di Pembahasan Kimia UN: Polimer.
Soal No. 27 tentang Termokimia (Reaksi Eksoterm)
Perhatikan beberapa persamaan reaksi kimia dalam kehidupan sehari-hari berikut!
(1) C6H12O6(aq) → 2C2H5OH(aq) + 2CO2(g)
(2) C6H12O6(aq) + O2(g) → 6CO2(g) + 6H2O(l)
(3) H2O(aq) → H2(g) + ½ O2(g)
(4) C8H18(g) + 12½O2(g) → 8CO2(g) + 9H2O(g)
(5) C(s) + 2H2O (g) → CO2(g) + 2H2(g)
Reaksi eksoterm terjadi pada ....
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)
(1) C6H12O6(aq) → 2C2H5OH(aq) + 2CO2(g)
(2) C6H12O6(aq) + O2(g) → 6CO2(g) + 6H2O(l)
(3) H2O(aq) → H2(g) + ½ O2(g)
(4) C8H18(g) + 12½O2(g) → 8CO2(g) + 9H2O(g)
(5) C(s) + 2H2O (g) → CO2(g) + 2H2(g)
Reaksi eksoterm terjadi pada ....
A. (1) dan (3)
B. (1) dan (5)
C. (2) dan (4)
D. (2) dan (5)
E. (3) dan (5)

Pembahasan
Reaksi eksoterm adalah reaksi yang melepaskan, membebaskan, mengeluarkan, atau menghasilkan kalor. Dengan demikian, pada akhir reaksi eksoterm terdapat kenaikan suhu, suhu menjadi lebih panas daripada sebelum reaksi. Yang termasuk reaksi eksoterm adalah:- reaksi pembakaran (reaksi dengan O2),
- reaksi netralisasi asam dan basa,
- reaksi korosi (oksidasi logam),
- reaksi polimerisasi,
- respirasi, dan
- dekomposisi tumbuhan menjadi kompos.
Soal No. 28 tentang Termokimia (Entalpi)
Perhatikan diagram entalpi berikut!
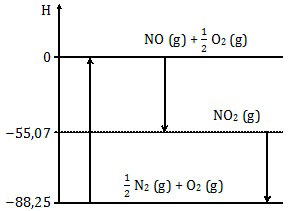
Entalpi reaksi ½ N2 (g) + O2 (g) → NO (g) + ½ O2 (g) adalah ....
A. −88,25 kJ
B. −55,07 kJ
C. −33,18 kJ
D. +33,18 kJ
E. +88,25 kJ

Entalpi reaksi ½ N2 (g) + O2 (g) → NO (g) + ½ O2 (g) adalah ....
A. −88,25 kJ
B. −55,07 kJ
C. −33,18 kJ
D. +33,18 kJ
E. +88,25 kJ
Pembahasan
Dalam diagram entalpi, arah panah ke atas adalah reaksi endoterm sedangkan arah panah ke bawah berarti eksoterm.Reaksi ½ N2 (g) + O2 (g) → NO (g) + ½ O2 (g) adalah reaksi ke atas atau endoterm. Reaksi endoterm mempunyai harga ΔH positif. Opsi A, B, dan C sudah pasti salah.
ΔHreaksi = ΔHhasil − ΔHpereaksi
ΔHreaksi = 0 − (−88,25) = +88,25
Jadi, entalpi reaksi tersebut adalah +88,25 kJ (E).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Soal No. 29 tentang Laju Reaksi
Berikut tabel hasil percobaan reaksi antara logam Q dengan larutan HCl 2M.
Laju reaksi pembentukan gas H2 pada suhu tersebut adalah ....
A. 0,7 ml/det
B. 1,0 ml/det
C. 1,4 ml/det
D. 2,0 ml/det
E. 2,8 ml/det
| No. | Suhu (°C) | Volume H2 (ml) | Waktu (detik) |
| 1 2 3 | 25 25 25 | 0 14 28 | 0 10 20 |
Laju reaksi pembentukan gas H2 pada suhu tersebut adalah ....
A. 0,7 ml/det
B. 1,0 ml/det
C. 1,4 ml/det
D. 2,0 ml/det
E. 2,8 ml/det
Pembahasan
Laju reaksi dalam satuan volume per waktu dirumuskan sebagai:ΔV adalah selisih volume yang bisa diambil dari data nomor 1 dan 2, 1 dan 3, atau 2 dan 3, demikian juga dengan Δt. Misal kita hitung laju reaksi berdasarkan data nomor 2 dan 3.
= 14/10
= 1,4
Adapun suhu, sebagaimana disebutkan dalam tabel, hanya berfungsi sebagai pemanis data. Suhu tidak berpengaruh karena semua menunjukkan angka 25 °C.
Jadi, laju reaksi pembentukan gas H2 adalah 1,4 ml/det (C).
Perdalam materi ini di Pembahasan Kimia UN: Laju Reaksi.
Soal No. 30 tentang Kesetimbangan Kimia
Pada reaksi kesetimbangan:
2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH = −y kJ
Jika volume diperkecil, kesetimbangan akan bergeser ke ....
A. kiri karena ke arah endoterm
B. kanan karena ke arah endoterm
C. kiri karena jumlah koefisien pereaksi lebih besar
D. kanan karena ke arah eksoterm
E. kanan karena jumlah koefisien hasil reaksi lebih kecil
2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH = −y kJ
Jika volume diperkecil, kesetimbangan akan bergeser ke ....
A. kiri karena ke arah endoterm
B. kanan karena ke arah endoterm
C. kiri karena jumlah koefisien pereaksi lebih besar
D. kanan karena ke arah eksoterm
E. kanan karena jumlah koefisien hasil reaksi lebih kecil
Pembahasan
Faktor yang memengaruhi pergeseran kesetimbangan:- Konsentrasi: jika konsentrasi ruas kiri diperbesar maka reaksi akan bergeser ke kanan. Sebaliknya, jika konsentrasi ruas kiri dikurangi maka reaksi akan bergeser ke kiri.
- Volume: jika volume sistem diperbesar maka reaksi akan bergeser ke ruas yang mempunyai jumlah koefisien lebih besar, demikian juga sebaliknya.
- Tekanan: jika tekanan sistem diperbesar maka reaksi akan bergeser ke ruas yang mempunyai jumlah koefisien lebih kecil, demikian juga sebaliknya.
- Suhu: Jika suhu sistem diperbesar maka reaksi akan bergeser ke endoterm, demikian juga sebaliknya.
Jadi, jika volume diperkecil maka reaksi akan bergeser ke kanan karena jumlah koefisiennya lebih kecil (E).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Simak Pembahasan Soal Kimia UN 2014 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan