- stoikiometri,
- tata nama dan persamaan reaksi,
- larutan elektrolit dan nonelektrolit,
- pH asam dan basa, serta
- larutan penyangga.
Soal No. 6 tentang Stoikiometri
Pada pembuatan gas amonia (NH3) menurut proses Haber Bosch, dilakukan dengan cara mereaksikan gas nitrogen dan gas hidrogen sesuai persamaan reaksi:
N2(g) + H2(g) → NH3(g) (belum setara)
Gas nitrogen (Ar N = 14) yang direaksikan sebanyak 14 gram. Volume gas amonia (NH3) yang dihasilkan pada keadaan 0 °C, 1 atm adalah ....
A. 1,12 liter
B. 2,24 liter
C. 11,2 liter
D. 22,4 liter
E. 33,6 liter
N2(g) + H2(g) → NH3(g) (belum setara)
Gas nitrogen (Ar N = 14) yang direaksikan sebanyak 14 gram. Volume gas amonia (NH3) yang dihasilkan pada keadaan 0 °C, 1 atm adalah ....
A. 1,12 liter
B. 2,24 liter
C. 11,2 liter
D. 22,4 liter
E. 33,6 liter
Pembahasan
Langkah pertama adalah menyetarakan reaksi terlebih dahulu.N2(g) + 3H2(g) → 2NH3(g)
Langkah berikutnya adalah menentukan nilai mol dari gas nitrogen. Hal ini karena hanya nilai besaran nitrogen yang diketahui, yaitu massa 14 gram dan Mr = 2 × 14 = 28.
Nilai mol N2 ini digunakan untuk menentukan nilai mol NH3 dengan memanfaatkan hukum kesetaraan antara mol dan koefisien.
Selanjutnya nilai mol NH3 ini digunakan untuk menentukan volume gas NH3. Volume pada keadaan 0 °C, 1 atm (STP) adalah 22,4 liter. Diperoleh:
volume NH3 = 1 × 22,4
= 22,4
Jadi, Volume gas amonia (NH3) yang dihasilkan pada keadaan 0 oC, 1 atm adalah 22,4 liter (D).
Perdalam materi ini di Pembahasan Kimia UN: Stoikiometri Larutan.
Soal No. 7 tentang Tata Nama dan Persamaan Reaksi
Serbuk tembaga (II) oksida larut dalam asam klorida membentuk tembaga (II) klorida dan air. Persamaan reaksi setara dan lengkap dari reaksi tersebut adalah ....
A. Cu2O (s) + HCl (aq) → Cu2Cl (aq) + H2O (l)
B. Cu2O (s) + 2HCl (aq) → 2 CuCl (aq) + H2O (l)
C. CuO (s) + HCl (aq) → CuCl (aq) + H2O (l)
D. CuO (s) + 2 HCl (aq) → CuCl2 (aq) + H2O (l)
E. Cu2O (s) + 4 HCl (aq) → 2 CuCl2 (aq) + 4 H2O (l)
A. Cu2O (s) + HCl (aq) → Cu2Cl (aq) + H2O (l)
B. Cu2O (s) + 2HCl (aq) → 2 CuCl (aq) + H2O (l)
C. CuO (s) + HCl (aq) → CuCl (aq) + H2O (l)
D. CuO (s) + 2 HCl (aq) → CuCl2 (aq) + H2O (l)
E. Cu2O (s) + 4 HCl (aq) → 2 CuCl2 (aq) + 4 H2O (l)

Pembahasan
Senyawa logam yang mempunyai atom logam dengan bilangan oksidasi lebih dari satu, penamaannya adalah:
nama logam + (huruf romawi biloks logam) + nama nonlogam + ida
- CuO : tembaga (II) oksida (biloks O = −2 sehingga biloks Cu = +2).
- Cu2O : tembaga (I) oksida (biloks O = −2 sehingga biloks 2 Cu = +2, biloks Cu = +1).
- CuCl : tembaga (I) klorida (biloks Cl = −1 sehingga biloks Cu = +1).
- CuCl2 : tembaga (II) klorida (biloks 2 Cl = −2 sehingga biloks Cu = +2).
- Cu2Cl : tidak ada senyawa Cu2Cl (lucu kan, kalau biloks Cu = ½).
Perdalam materi ini di Pembahasan Soal UN: Persamaan Reaksi Sederhana.
Soal No. 8 tentang Larutan Elektrolit dan Nonelektrolit
Berikut data hasil pengujian terhadap beberapa air limbah beserta nilai derajat ionisasinya (α).
Pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah ....
A. K dan L
B. K dan M
C. L dan M
D. L dan N
E. L dan O
| Air Limbah | Nyala Lampu | Gelembung Gas | α |
| K L M N O | terang tidak tidak tidak redup | ada ada tidak ada tidak ada ada | 1 0,001 0 0 1 |
Pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah ....
A. K dan L
B. K dan M
C. L dan M
D. L dan N
E. L dan O
Pembahasan
Untuk menjawab soal di atas, perhatikan tabel berikut!| Larutan | Nyala Lampu | Gelembung Gas | α |
| Elektrolit kuat Elektrolit lemah Nonelektrolit | terang redup mati | banyak sedikit tidak ada | 1 0 < α < 1 0 |
Berdasarkan tabel di atas, pasangan air limbah yang bersifat elektrolit kuat dan nonelektrolit adalah K dan M atau K dan N. Opsi jawaban yang ada adalah K dan M (B).
Perdalam materi ini di Pembahasan Kimia UN: Larutan Elektrolit dan Nonelektrolit.
Soal No. 9 tentang pH Asam dan Basa
Gas HCl murni 24 ml ditiupkan ke dalam 250 ml air sehingga tidak merubah volume air. Tekanan gas semula 76 cmHg dan temperaturnya 27 °C. Kalau tetapan gas ideal adalah R = 0,08 L.atm/mol.K dan log 4 = 0,6 maka pH larutan HCl adalah ....
A. 1,70
B. 2,40
C. 2,47
D. 3,20
E. 3,40
A. 1,70
B. 2,40
C. 2,47
D. 3,20
E. 3,40
Pembahasan
Kita tentukan dulu nilai mol dari gas HCl. Namun sebelumnya kita mengonversi beberapa satuan sebagai berikut:V = 24 ml
= 24 × 10−3 liter.
p = 76 cmHg
= 1 atm.
T = 27 °C
= 300 K
Mengonversi satuan tersebut karena pada tetapan R terkandung satuan liter, atm, dan K.
Selanjutnya, mari kita tentukan nilai mol gas HCl dengan menggunakan persamaan gas umum pV = nRT.
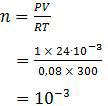
Gas HCl 10−3 mol tersebut ditiupkan ke dalam 250 ml air sehingga konsentrasi molarnya adalah:

Dengan konsentrasi molar tersebut, gas HCl yang terlarut dalam air mempunyai pH:
[H+] = a × M
= 1 × 4 ⋅ 10−3
= 4 ⋅ 10−3
pH = 3 − log 4
= 3 − 0,6 = 2,4
Jadi, pH larutan gas HCl adalah 2,40 (B).
Perdalam materi ini di Pembahasan Kimia UN: Asam dan Basa.
Soal No. 10 tentang Larutan Penyangga
Perhatikan kurva perubahan harga pH pada titrasi CH3COOH dengan NaOH berikut!
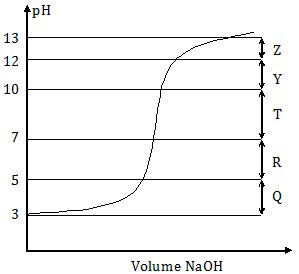
Daerah kurva yang merupakan larutan penyangga adalah ....

Daerah kurva yang merupakan larutan penyangga adalah ....
A. R
B. T
C. Z
D. Y
E. Q
Pembahasan
Larutan penyangga adalah larutan yang berfungsi untuk mempertahan pH dari penambahan sedikit asam, sedikit basa, atau pengenceran.Pada soal di atas, asam asetat atau CH3COOH yang bersifat asam lemah dititrasi oleh NaOH yang bersifat basa kuat. Pada awal titrasi, asam asetat cenderung mempertahankan pH-nya. Tetapi jika titrasi dilanjutkan maka asam asetat sudah tidak dapat lagi mempertahankan pH-nya. pH-nya akan semakin naik sampai menjadi basa.
Jadi, kurva yang merupakan larutan penyangga adalah kurva awal titrasi yang cenderung mendatar, yaitu Q (E).
Simak Pembahasan Soal Kimia UN 2014 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

sangattt membantuuu
ReplyDeleteTerima kasih, semoga bermanfaat.
DeleteThankyuo
ReplyDeleteSangat membantu dalam belajar
ReplyDeleteMakasih, semoga berkah
Delete