- reaksi eksoterm,
- reaksi endoterm,
- laju reaksi,
- kesetimbangan kimia, dan
- faktor laju reaksi.
Soal No. 26 tentang Termokimia (Reaksi Eksoterm)
Perhatikan gambar percobaan berikut!
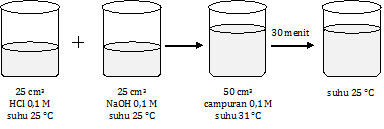
Massa jenis air dianggap 1 g/cm3 dan kalor jenis air 4,2 J/g°C.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
ΔH reaksi untuk per mol H2O yang terbentuk adalah ....
A. −50,40 kJ
B. −51,50 kJ
C. −54,60 kJ
D. −55,44 kJ
E. −57,10 kJ

Massa jenis air dianggap 1 g/cm3 dan kalor jenis air 4,2 J/g°C.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
ΔH reaksi untuk per mol H2O yang terbentuk adalah ....
A. −50,40 kJ
B. −51,50 kJ
C. −54,60 kJ
D. −55,44 kJ
E. −57,10 kJ
Pembahasan
Pada gambar percobaan di atas, setelah HCl dicampur dengan NaOH, terjadi kenaikan suhu sebesar 6 °C, yaitu dari 25 °C menjadi 31 °C. Ini menunjukkan bahwa reaksi yang terjadi adalah reaksi eksoterm (pelepasan panas).Adapun setelah 30 menit suhu turun kembali menjadi 25 °C, bukan berarti terjadi reaksi endoterm. Ini adalah proses penurunan suhu saja, karena reaksi sudah selesai.
ΔH untuk reaksi eksoterm dirumuskan:

Tada negatif menunjukkan bahwa reaksi tersebut menghasilkan kalor atau eksoterm. Besarnya kalor yang dilepas pada reaksi tersebut adalah
Q = m.c.Δt, [m = ρ.V]
= ρ.V.c.Δt
= 1 × 50 × 4,2 × 6 J
= 1260 J
Sekarang perhatikan persamaan reaksinya. Pada persamaan reaksi tersebut, semua koefisiennya sama, yaitu 1 sehingga
mol H2O = mol HCl
= M × V
= 0,1 M × 25 ml
= 2,5 mmol
= 2,5 × 10−3 mol
Dengan demikian, entalpi reaksi H2O adalah

Jadi, ΔH reaksi per mol H2O yang terbentuk adalah −50,40 kJ (A).
Soal No. 27 tentang Termokimia (Reaksi Endoterm)
Perhatikan peristiwa yang terjadi dalam kehidupan sehari-hari berikut ini!
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
- Bensin (C8H18) dibakar dalam karburator.
- Fotosintesis pada tumbuhan.
- Besi berkarat.
- Air keringat menguap ketika berolahraga.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)

Pembahasan
Reaksi endoterm adalah reaksi yang menyerap atau membutuhkan kalor. Pada reaksi ini terjadi penurunan suhu. Sedangkan reaksi eksoterm adalah reaksi yang melepas atau menghasilkan kalor sehingga terjadi kenaikan suhu.- Bensin dibakar akan melepas kalor ditandai dengan body mesin yang semakin panas (eksoterm).
- Fotosintesis pada tumbuhan membutuhkan energi matahari (endoterm).
- Besi berkarat atau korosi adalah reaksi oksidasi yang melepas energi (eksoterm).
- Air keringat menguap ketika berolahraga karena saat berolahraga terjadi pembakaran atau dihasilkan energi. Energi ini kemudian diserap keringat sehingga keringat menguap (endoterm).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Soal No. 28 tentang Laju Reaksi
Pada percobaan reaksi antara logam aluminium dan asam sulfat sesuai persamaan reaksi:
2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Gas hidrogen ditampung dan diukur volumenya pada temperatur yang tetap. Data pengukuran tiap waktu sesuai tabel berikut:
Laju reaksi pembentukan gas hidrogen setelah 30 detik sebesar ....
A. 0,83 ml/detik
B. 1,33 ml/detik
C. 2,67 ml/detik
D. 2,50 ml/detik
E. 7,50 ml/detik
2Al(s) + 3H2SO4(aq) → Al2(SO4)3(aq) + 3H2(g)
Gas hidrogen ditampung dan diukur volumenya pada temperatur yang tetap. Data pengukuran tiap waktu sesuai tabel berikut:
| No. | Waktu Reaksi (detik) | Volume Gas (ml) |
| 1 | 0 | 0 |
| 2 | 15 | 40 |
| 3 | 30 | 80 |
Laju reaksi pembentukan gas hidrogen setelah 30 detik sebesar ....
A. 0,83 ml/detik
B. 1,33 ml/detik
C. 2,67 ml/detik
D. 2,50 ml/detik
E. 7,50 ml/detik
Pembahasan
Laju reaksi pembentukan gas hidrogen pada detik ke-15:
Laju reaksi pembentukan gas hidrogen pada detik ke-30:

Laju reaksi pada detik ke-15 dan detik ke-30 mempunyai nilai yang sama. Berarti reaksi tersebut berjalan dengan kecepatan konstan (mempunyai nilai v yang sama setiap nilai t)
Jadi, laju reaksi pembentukan gas hidrogen setelah detik 30 detik juga sama, yaitu 2,67 ml/detik (C).
Perdalam materi ini di Pembahasan Kimia UN: Laju Reaksi.
Soal No. 29 tentang Kesetimbangan Kimia
Dalam ruang 2 liter terdapat kesetimbangan:
PCl5(g) ⇌ PCl3(g) + Cl2(g)
Data percobaan pada keadaan kesetimbangan sebagai berikut:
Harga Kc berdasarkan data tersebut adalah ....
PCl5(g) ⇌ PCl3(g) + Cl2(g)
Data percobaan pada keadaan kesetimbangan sebagai berikut:
| Keadaan | PCl5 (mol) | PCl3 (mol) | Cl2 (mol) |
| Mula-mula | 1,4 | - | - |
| Bereaksi | 0,6 | 0,6 | 0,6 |
| Setimbang | 0,8 | 0,6 | 0,6 |
Harga Kc berdasarkan data tersebut adalah ....
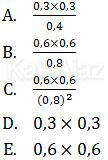
Pembahasan
Konstanta kesetimbangan konsentrasi (Kc) adalah perbandingan konsentrasi produk terhadap konsentrasi reaktan dengan masing-masing konsentrasi dipangkatkan koefisiennya.
Nilai konsentrasi yang dimasukkan dalam rumus tersebut adalah nilai konsentrasi pada saat setimbang. Yang perlu diingat, besaran konsentrasi yang dilambangkan dengan kurung siku adalah konsentrasi dalam satuan molar.
Sedangkan konsentrasi yang tersedia pada tabel adalah konsentrasi dalam satuan mol. Jadi, masing-masing harus dibagi V = 2 liter terlebih dahulu.

Jadi, harga Kc berdasarkan data tersebut adalah opsi (A).
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 30 tentang Faktor Laju Reaksi
Perhatikan data percobaan berikut dengan teliti!
Perubahan laju reaksi pada percobaan 2 dan 3 dipengaruhi oleh ....
A. waktu
B. massa
C. luas permukaan
D. konsentrasi larutan
E. suhu
| Percobaan | Konsentrasi HCl (volume 25 ml) | Ukuran Partikel Pualam (2 gram) | Suhu Awal (Celsius) | Waktu Reaksi (menit) |
| 1 | 2 M | kerikil | 25 | 4 |
| 2 | 1 M | kerikil | 25 | 10 |
| 3 | 1 M | serbuk | 25 | 3 |
| 4 | 1 M | kerikil | 35 | 1 |
| 5 | 0,5 M | serbuk | 25 | 8 |
Perubahan laju reaksi pada percobaan 2 dan 3 dipengaruhi oleh ....
A. waktu
B. massa
C. luas permukaan
D. konsentrasi larutan
E. suhu
Pembahasan
Percobaan 2 dan 3 mempunyai konsentrasi dan suhu yang sama. Perbedaannya hanya pada ukuran partikel. Sedangkan ukuran partikel berhubungan dengan luas permukaan. Semakin halus ukuran partikel, semakin besar luas permukaannya sehingga reaksi berjalan lebih cepat.Jadi, perubahan laju reaksi pada percobaan 2 dan 3 dipengaruhi oleh luas permukaan (C).
Simak Pembahasan Soal Kimia UN 2015 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

terimakasih... Ini Sangat sangat membantu
ReplyDeleteSama-sama, semoga bermanfaat
Deleteupdate lagi pak
ReplyDeleteInsya Allah. Terima kasih atas dukungannya
DeleteTerimakasih banyak pak
ReplyDeleteSangat bermanfaat sekali
Terima kasih kembali. Semoga berkah
Delete