- sifat koligatif larutan,
- larutan penyangga,
- teori asam dan basa,
- senyawa karbon, serta
- reaksi senyawa karbon.
Soal No. 41 tentang Sifat Koligatif Larutan
Larutan A dibuat dengan melarutkan 0,01 mol urea dalam 500 g air. Larutan B dibuat dengan melarutkan 0,001 mol NaBr dan 0,001 mol Na2SO4 dalam 500 g air. Kedua garam ini terdisosiasi sempurna dalam air. Perbandingan penurunan titik beku larutan A terhadap larutan B adalah ….
A. 2 : 3
B. 1 : 2
C. 1 : 1
D. 3 : 2
E. 2 : 1
A. 2 : 3
B. 1 : 2
C. 1 : 1
D. 3 : 2
E. 2 : 1
Pembahasan
Penurunan titik beku larutan dirumuskan sebagai: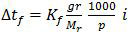
Sesuai dengan data pada soal, rumus di atas bisa diubah menjadi (n = jumlah mol):

Larutan A adalah 0,01 mol urea yang merupakan larutan nonelektrolit (i = 1) sehingga penurunan titik didihnya adalah:
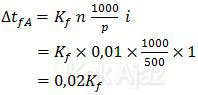
Sedangkan larutan B merupakan larutan elektrolit yang terdiri dari:
NaBr i = 2 (1 Na+, 1 Br−)
Na2SO4 i = 3 (2Na+ dan 1 SO42−)
Karena NaBr dan Na2SO4 mempunyai jumlah mol yang sama serta dilarutkan dalam pelarut yang sama maka penurunan titik beku larutan B adalah:
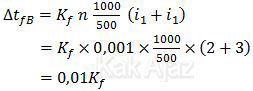
Dengan demikian, perbandingan ∆tfA : ∆tfB adalah:

Jadi, perbandingan penurunan titik beku larutan A terhadap larutan B adalah 2 : 1 (E).
Soal No. 42 tentang Larutan Penyangga
Natrium hidroksida (NaOH) dan asam sianida (HCN dengan Ka = 4 × 10−10) masing-masing sebanyak 0,1 dan 0,15 mol dilarutkan dalam air hingga diperoleh larutan dengan volume 100 mL. pH larutan yang diperoleh adalah ….
A. 3 + log 2
B. 10 − 2 log 2
C. 10 − log 2
D. 10 + 2 log 2
E. 9 + log 2
A. 3 + log 2
B. 10 − 2 log 2
C. 10 − log 2
D. 10 + 2 log 2
E. 9 + log 2

Pembahasan
Persamaan reaksi yang terjadi antara natrium hidroksida dan asam sianida adalah:| NaOH | + HCN | → NaCN | + H2O | ||
| mula-mula | : | 0,10 | 0,15 | - | - |
| reaksi | : | 0,10 | 0,10 | 0,10 | 0,10 |
| sisa | : | - | 0,05 | 0,10 | 0,10 |
Sisa asam lemah HCN dan garam NaCN tersebut akan membentuk larutan penyangga asam. pH larutan penyangga asam dapat dicari melalui rumus:
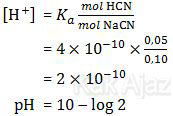
Jadi, pH larutan yang diperoleh adalah 10 − log 2 (C).
Soal No. 43 tentang Teori Asam dan Basa
Suatu reaksi berlangsung sebagai berikut:
CO32− + SO3 ⇌ SO42− + CO2
Pernyataan yang BENAR terkait reaksi tersebut adalah ….
A. CO32− bertindak sebagai asam Bronsted-Lowry
B. SO42− bertindak sebagai asam Lewis
C. CO2 bertindak sebagai asam Bronsted-Lowry
D. CO2 bertindak sebagai basa Lewis
E. SO3 bertindak sebagai asam Lewis
CO32− + SO3 ⇌ SO42− + CO2
Pernyataan yang BENAR terkait reaksi tersebut adalah ….
A. CO32− bertindak sebagai asam Bronsted-Lowry
B. SO42− bertindak sebagai asam Lewis
C. CO2 bertindak sebagai asam Bronsted-Lowry
D. CO2 bertindak sebagai basa Lewis
E. SO3 bertindak sebagai asam Lewis
Pembahasan
Tiga teori asam basa yang perlu diketahui, yaitu:Teori Arrhenius
Asam : zat yang di dalam air melepaskan ion H+.Ciri: ruas kanan terdapat H+
Contoh:
HCl(aq) → H+ + Cl−
Basa : zat yang di dalam air melepaskan ion OH−
Ciri: ruas kanan terdapat OH−
Contoh:
NaOH(aq) → Na+ + OH−
Teori Bronsted-Lowry
Teori ini dikenal sebagai teori asam basa konjugasi/pasangan.Asam : donor proton (kelebihan 1 H+ terhadap konjugatnya)
Basa : akseptor proton (kekurangan 1 H+ terhadap konjugatnya)
Contoh:

HCl berkonjugasi dengan Cl−. Karena HCl kelebihan 1 H+ terhadap Cl− maka HCl bertindak sebagai asam sedangkan Cl− bertindak sebagai basa. Demikian juga dengan H2O dan H3O+.
Teori Lewis
Asam : akseptor elektron (kekurangan elektron/lebih positif)Basa : donor elektron (kelebihan elektron/lebih negatif)
Teori ini sama saja dengan teori Bronsted-Lowry. Kelebihannya, teori Lewis dapat menentukan asam/basa meskipun suatu senyawa tidak mengandung unsur H.
Berdasarkan ketiga teori di atas, reaksi yang berlangsung pada soal hanya bisa ditentukan asam/basanya dengan teori Lewis (karena tidak ada kandungan unsur H).

SO3 lebih positif daripada SO42− sehingga SO3 bertindak sebagai asam sedangkan SO42− bertindak sebagai basa. Demikian juga dengan CO2 dan CO32−.
Jadi, pernyataan yang benar adalah SO3 bertindak sebagai asam Lewis (E).
Soal No. 44 tentang Senyawa Karbon
Perhatikan senyawa-senyawa di bawah ini!
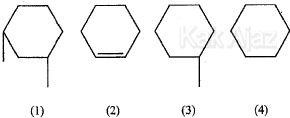
Di antara senyawa-senyawa di atas, senyawa yang mempunyai isomer cis-trans adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 1
E. 2

Di antara senyawa-senyawa di atas, senyawa yang mempunyai isomer cis-trans adalah ….
A. 1 dan 2
B. 1 dan 3
C. 2 dan 4
D. 1
E. 2
Pembahasan
Isomer cis-trans hanya terjadi pada senyawa karbon:- golongan alkena dan sikloalkana
- atom yang berikatan rangkap (untuk alkena) masing-masing harus mengikat dua gugus yang berbeda
- terdapat dua atom C (untuk sikloalkana) yang masing-masing mengikat dua gugus yang berbeda
Sekarang kita bandingkan gambar 1 dan gambar 3. Pada gambar 1 terdapat 2 atom C yang mengikat gugus berbeda. Sedangkan pada gambar 3 hanya ada 1 atom C yang mengikat gugus berbeda. Sehingga sudah pasti yang mempunyai isomer cis-trans adalah gambar 1.
Mari kita perhatikan senyawa gambar 1. Anggap saja gugus yang diikat adalah gugus X.

Perhatikan, 2 atom C yang berwarna biru masing-masing mengikat 2 gugus yang berbeda, yaitu X dan H. Sedangkan atom C yang lain mengikat gugus yang sama, yaitu H saja.
Sekarang perhatikan isomer cis dan trans yang terjadi pada gambar berikut ini!

Isomer cis terjadi apabila gugus yang sejenis terletak bersebelahan. Sedangkan isomer trans terjadi bila gugus yang sejenis berseberangan.
Jadi, senyawa yang mempunyai isomer cis-trans adalah senyawa nomor 1(D).
Soal No. 45 tentang Reaksi Senyawa Karbon
Pembuatan metil asetat dapat dilakukan menurut reaksi berikut:
CH3COOH + CH3OH → CH3COOCH3 + H2O
Jenis reaksi yang terjadi adalah ….
A. eliminasi
B. kondensasi
C. hidrolisis
D. oksidasi
E. adisi
CH3COOH + CH3OH → CH3COOCH3 + H2O
Jenis reaksi yang terjadi adalah ….
A. eliminasi
B. kondensasi
C. hidrolisis
D. oksidasi
E. adisi
Pembahasan
Metil asetat termasuk golongan ester. Sehingga reaksi di atas adalah reaksi esterifikasi.CH3COOH + CH3OH → CH3COOCH3 + H2O
Reaksi esterifikasi merupakan reaksi substitusi karena terjadi pertukaran antara atom H pada CH3COOH dengan gugus CH3− pada CH3OH. Namun sayang sekali reaksi substitusi tidak ada pada opsi jawaban.
Mari kita ulas satu per satu jenis reaksi pada setiap opsi jawaban!
- Reaksi eliminasi adalah reaksi pembentukan ikatan rangkap.
Pada reaksi di atas tidak terdapat ikatan rangkap. [opsi A salah]
- Reaksi kondensasi adalah reaksi penggabungan dua senyawa yang menghasilkan senyawa lebih besar. Dalam reaksi ini juga dihasilkan senyawa yang sederhana.
Pada reaksi di atas terjadi penggabungan antara asam asetat dan metanol membentuk metil asetat (senyawa lebih besar) dan air (senyawa sederhana). [opsi B benar]
- Reaksi hidrolisis adalah reaksi penguraian suatu senyawa oleh air.
Reaksi kebalikan dari reaksi di atas merupakan reaksi hidrolisis ester. [opsi C salah]
- Reaksi oksidasi adalah reaksi peningkatan bilangan oksidasi.
Karena reaksi di atas merupakan reaksi substitusi maka tidak mungkin terjadi perubahan bilangan oksidasi. [opsi D salah]
- Reaksi adisi adalah reaksi pemutusan ikatan rangkap (kebalikan reaksi eliminasi).
Pada reaksi di atas tidak terdapat ikatan rangkap. [opsi E salah]Jadi, jenis reaksi yang terjadi adalah reaksi kondensasi (B).
Simak Pembahasan Soal TKD Saintek SBMPTN 2016 selengkapnya.
Simak juga:
Pembahasan Kimia SBMPTN 2014
Pembahasan Kimia SBMPTN 2015
Pembahasan Kimia SBMPTN 2017
Pembahasan Kimia UTBK SBMPTN 2019
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

Kak maaf kalau magnesium sulfat terdisosiasi sempurna dalam air, faktor van hoff (i) nya berapa ya?
ReplyDeleteMagnesium sulfat (MgSO4) jika terdisosisi sempurna akan menjadi 2 partikel yairu:
Delete1 ion Mg^2+ dan
1 ion SO4^2-
sehingga i = 2.
Oh iya pak terimakasih saya kira yang dijumlahkan itu 2 dgn 2, jadi ion itu sama seperti koefisiennya pak?
ReplyDeleteYa,
DeleteTerima kasih kembali. Semoga lebih semangat belajar
Terimakasih
ReplyDeleteSangat bermanfaat
Terima kasih kembali, Fauzi.
Deletemantapp kak. saya sangat berterima kasih, penjelasannya detail kak...
ReplyDeleteTerima kasih, Arya. Semoga bekah dan manfaat
Delete