Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 1 sampai dengan nomor 5 tentang:
- teori atom,
- struktur atom [massa relatif],
- sistem periodik unsur,
- sistem periodik unsur [konfigurasi elektron], dan
- hukum dasar kimia.
Soal No. 1 tentang Teori Atom
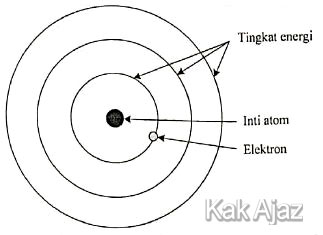
Perhatikan gambar dan beberapa pernyataan tentang model atom berikut!
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)

- Tidak dapat menjelaskan spektra atom hidrogen.
- Tidak dapat menerangkan pengaruh medan magnet terhadap spektrum atom.
- Tidak dapat menjelaskan tingkat-tingkat energi atom hidrogen.
- Tidak dapat menerangkan struktur atom berelektron banyak.
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Model atom pada gambar di atas adalah model atom Bohr. Cirinya, terdapat tingkat-tingkat energi.Adapun kelemahan model atom tom Bohr adalah:
- Efek Zeeman, yaitu gejala tambahan garis spektrum jika atom tereksitasi dalam medan magnet [pernyataan 2 benar]
- Anomali Efek Zeeman, yaitu struktur halus
- Spektrum atom berelektron banyak [pernyataan 4 benar]
Jadi, pasangan pernyataan yang benar tentang kelemahan model atom tersebut adalah pernyataan 2 dan 4 (D).
Soal No. 2 tentang Struktur Atom [massa relatif]
Massa rata-rata satu atom P adalah 6,64 × 10−23 gram, sedangkan massa satu atom karbon C-12 adalah 1,992 × 10−23 gram. Massa atom relatif (Ar) untuk unsur P adalah ….
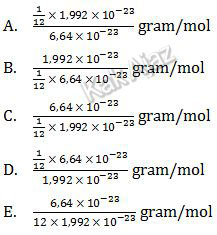
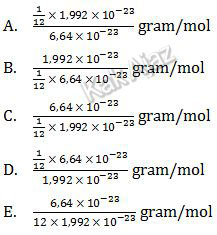
Pembahasan
Massa atom relatif (Ar) adalah perbandingan massa rata-rata suatu unsur dengan 1/12 massa 1 atom C-12. Massa atom relatif unsur P dirumuskan:
Jadi, massa atom relatif untuk unsur P adalah opsi (C).
Perdalam materi ini di Pembahasan Kimia UN: Struktur Atom.
Soal No. 3 tentang Sistem Periodik Unsur
Perhatikan hubungan notasi unsur, konfigurasi elektron, dan letaknya dalam tabel periodik unsur berikut!

Data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur ….
A. K
B. L
C. M
D. N
E. O

Data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur ….
A. K
B. L
C. M
D. N
E. O

Pembahasan
Sebenarnya hanya dengan memperhatikan data proton dan neutron, jawaban sudah ketemu.ZXA
Z : jumlah proton = jumlah elektron
A : jumlah proton + jumlah neutron
Unsur yang memenuhi kaidah di atas hanta unsur N.
Ok, kita lanjutkan menentukan golongan dan periode. Yang perlu diperhatikan adalah elektron valensi pada konfigurasi elektronnya.
Golongan A : ns
ns np
Golongan B : ns (n − 1)d
Sedangkan periode dan golongan ditentukan sebagai berikut:
Periode : nilai n pada ns
Golongan : jumlah elektron valensi
Kecuali pada golongan B, jumlah elektron valensi 8, 9, dan 10 masuk golongan VIIIB. Sedangkan jumlah elektron 11 dan 12 masing-masing golongan IB dan IIB.
Berikut hasil pengisian data yang benar [yang dicetak biru adalah data yang sudah diperbaiki].

Jadi, data yang berhubungan dengan tepat ditunjukkan oleh notasi unsur N (D).
Perdalam materi ini di Pembahasan Kimia UN: Sistem Periodik Unsur.
Soal No. 4 tentang Sistem Periodik Unsur [konfigurasi elektron]
Unsur Y termasuk unsur transisi dan memiliki notasi 24Y52. Konfigurasi elektron unsur Y pada keadaan dasar adalah ….
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d5
C. 1s2 2s2 2p6 3s2 3p6 3d10
D. 1s2 2s2 2p6 3s2 3p6 4s0 4p4
E. 1s2 2s2 2p6 3s2 3p6 4s0 4d5
A. 1s2 2s2 2p6 3s2 3p6 4s2 3d4
B. 1s2 2s2 2p6 3s2 3p6 4s1 3d5
C. 1s2 2s2 2p6 3s2 3p6 3d10
D. 1s2 2s2 2p6 3s2 3p6 4s0 4p4
E. 1s2 2s2 2p6 3s2 3p6 4s0 4d5
Pembahasan
Konfigurasi elektron pada keadaan dasar adalah konfigurasi elektron yang sesuai dengan prinsip Aufbau.24Y : 1s2 2s2 2p6 3s2 3p6 4s2 3d4 (keadaan dasar)
24Y : 1s2 2s2 2p6 3s2 3p6 4s1 3d5 (menyimpang dari aturan Aufbau karena lebih stabil dengan keadaan subkulit s dan d terisi setengah penuh)
Jadi, konfigurasi elektron unsur Y pada keadaan dasar adalah opsi (A).
Perdalam materi ini di:
Pembahasan Kimia UN: Sistem Periodik Unsur
Materi Kimia UN: Konfigurasi Elektron pada Keadaan Dasar
Soal No. 5 tentang Hukum Dasar Kimia
Proses industri pembuatan amonia dapat dibuat dari reaksi antara gas nitrogen dan hidrogen, dengan persamaan reaksi:
N2(g) + H2(g) → NH3(g) ∆H = −92,4 kJ
Reaksi berlangsung pada suhu dan tekanan tinggi dengan menggunakan katalisator serbuk Fe dicampur dengan Al2O3, MgO, CaO, dan K2O. Perbandingan volume gas-gas yang bereaksi dan hasil reaksi pada P dan T yang sama ternyata 1 : 3 dan 2. Berdasarkan wacana tersebut, hukum kimia yang berlaku adalah ….
A. Hukum Dalton
B. Hukum Gay-Lussac
C. Hukum Avogadro
D. Hukum Lavoisier
E. Hukum Proust
N2(g) + H2(g) → NH3(g) ∆H = −92,4 kJ
Reaksi berlangsung pada suhu dan tekanan tinggi dengan menggunakan katalisator serbuk Fe dicampur dengan Al2O3, MgO, CaO, dan K2O. Perbandingan volume gas-gas yang bereaksi dan hasil reaksi pada P dan T yang sama ternyata 1 : 3 dan 2. Berdasarkan wacana tersebut, hukum kimia yang berlaku adalah ….
A. Hukum Dalton
B. Hukum Gay-Lussac
C. Hukum Avogadro
D. Hukum Lavoisier
E. Hukum Proust
Pembahasan
Reaksi setara untuk reaksi di atas adalah:N2(g) + 3H2(g) → 2NH3(g) ∆H = −92,4 kJ
Ternyata koefisien reaksi di atas setara dengan perbandingan volumenya. Hal ini sesuai dengan Hukum Perbandingan Volume (Hukum Gay-Lussac) yang berbunyi:
Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi merupakan bilangan bulat sederhana.Jadi, hukum kimia yang berlaku adalah Hukum Gay-Lussac (B).
Perdalam materi ini di Pembahasan Kimia UN: Hukum Dasar Kimia.
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan