
Pembahasan soal Kimia Tes Kompetensi Akademik Sains dan Teknologi (TKA Saintek) pada Ujian Tulis Berbasis Komputer (UTBK) Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN) tahun 2019 nomor 51 sampai dengan nomor 55 tentang:
- sifat koligatif larutan,
- reaksi redoks,
- pengenceran,
- elektrokimia, dan
- kimia unsur.
Soal No. 51 tentang Sifat Koligatif Larutan
Di bawah ini menunjukkan fenomena yang dapat diamati dalam kehidupan sehari-hari. Dari fenomena berikut, yang tidak menunjukkan sifat koligatif adalah ….
| A. | Titik beku menurun ketika ditambahkan garamnya |
| B. | Lobster air laut akan mati jika disimpan dalam air tawar |
| C. | Zat anti-beku ditambahkan ke dalam radiator untuk menjaga mesin mobil agar tetap dingin |
| D. | Pada daerah pegunungan, waktu untuk memasak spaghetti menjadi lebih lama |
| E. | Pencairan salju menggunakan garam dapur |
Pembahasan
Mari kaji satu per satu fenomena di atas!- Titik beku pelarut (misal air) akan turun jika ditambahkan zat terlarut (misal garam). [sifat koligatif]
- Air laut (mengandung garam) mempunyai tekanan uap yang lebih rendah daripada air tawar. Jika lobster air laut disimpan dalam air tawar yang tekanan uapnya lebih tinggi maka partikel air tawar akan mengalami osmosis memasuki tubuh lobster. Akibatnya, lobster kelebihan cairan, menggembung, dan mati. [sifat koligatif]
- Zat anti-beku (misal etilen glikol) yang ditambah pada air radiator bertujuan untuk menurunkan titik beku sehingga air radiator tetap dingin tetapi tidak sampai membeku. [sifat koligatif]
- Daerah pegunungan mempunyai tekanan udara yang lebih rendah daripada daerah pantai sehingga titik didih daerah pegunungan kurang dari 100 ℃. Namun, untuk mematangkan spaghetti membutuhkan suhu yang lebih tinggi. Oleh karena itu, memasak spaghetti di pegunungan membutuhkan waktu yang lebih lama. [bukan sifat koligatif]
- Garam dapur dan urea dapat menurunkan titik beku salju sehingga salju cepat mencair. [sifat koligatif]
Bacaan untuk soal nomor 52 dan 53
Diketahui reaksi:
6H+ + 5SO32− + 2MnO4− → 5SO42− + 2Mn2+ + 3H2O
Dalam suatu reaksi digunakan 100 mL larutan H2SO3 0,1 M dan 100 mL KMNO4 yang didapat dari pengenceran 5 mL KMnO4 2 M.
6H+ + 5SO32− + 2MnO4− → 5SO42− + 2Mn2+ + 3H2O
Dalam suatu reaksi digunakan 100 mL larutan H2SO3 0,1 M dan 100 mL KMNO4 yang didapat dari pengenceran 5 mL KMnO4 2 M.
Soal No. 52 tentang Reaksi Redoks
Elektron yang terlibat untuk setiap 5 mol SO32− adalah ….
| A. | 2 mol |
| B. | 5 mol |
| C. | 7 mol |
| D. | 10 mol |
| E. | 14 mol |
Pembahasan
Elektron yang terlibat dalam SO32− bisa kita ketahui dari perubahan biloks S pada reaksi di atas. Cukup kita perhatian setengah reaksinya saja.
Dengan demikian, elektron yang terlibat tiap 5 mol SO32− adalah:
2 × 5 mol = 10 mol
Jadi, jumlah elektron yang terlibat untuk setiap 5 mol SO32− adalah 10 mol (D).
Soal No. 53 tentang Pengenceran
Konsentrasi larutan MnO4− hasil pengenceran yang digunakan adalah ….
| A. | 0,01 M |
| B. | 0,05 M |
| C. | 0,10 M |
| D. | 0,15 M |
| E. | 0,20 M |

Pembahasan
MnO4− atau KMnO4 sebelum pengenceran adalah:| V1 | = | 5 mL |
| M1 | = | 2 M |
Setelah pengenceran diperoleh volume 100 mL sehingga konsentrasinya adalah:
| M1 ∙ V1 | = | M2 ∙ V2 |
| 2 ∙ 5 | = | M2 ∙ 100 |
| 10 | = | 100M2 |
| M2 | = | 0,1 M |
Jadi, konsentrasi larutan MnO4− hasil pengenceran yang digunakan adalah 0,10 M (C).
Soal No. 54 tentang Elektrokimia
Sebuah sel Galvani tersusun dari elektroda grafit yang dicelupkan ke dalam larutan KMnO4 dalam suasana asam dan elektroda Zn yang dicelupkan dalam larutan Zn(NO3)2. Jika sel tersebut dioperasikan, pernyataan yang benar adalah ….
(E0 Zn2+ | Zn = −0,76 V dan MnO4− | Mn2+ = 1,49 V)
(E0 Zn2+ | Zn = −0,76 V dan MnO4− | Mn2+ = 1,49 V)
| A. | pH larutan Zn(NO3)2 bertambah |
| B. | pH larutan KMnO4 berkurang |
| C. | elektron mengalir dari elektroda grafit ke elektroda Zn |
| D. | konsentrasi ion Zn2+ bertambah |
| E. | konsentrasi ion MnO4− bertambah |
Pembahasan
Berdasarkan data pada soal, potensial reduksi MnO4− lebih besar daripada Zn sehingga MnO4− bertindak sebagai katoda (mengalami reduksi) sedangkan Zn bertindak sebagai anoda (mengalami oksidasi.| Katoda | : | MnO4− + 8H+ + 5e → Mn2+ + 4H2O |
| Anoda | : | Zn → Zn2+ + 2e |
Dari reaksi di atas dapat disimpulkan:
- pH larutan Zn(NO3)2 dan KMnO4 tidak mengalami perubahan karena tidak dihasilkan ion H+ maupun OH− baik pada katoda maupun anoda. [opsi A dan B salah]
- Elektron dihasilkan di anoda kemudian ditangkap oleh katoda sehingga elektron mengalir dari Zn ke grafit. [opsi C salah]
- Konsentrasi Zn2+ bertambah karena merupakan produk anoda. [opsi D benar]
- Konsentrasi MnO4− berkurang karena merupakan reaktan katoda. [opsi E salah]
Soal No. 55 tentang Kimia Unsur
Perhatikan tabel berikut ini!
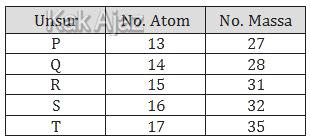
Unsur yang dapat mempunyai bilangan oksidasi +7 dalam senyawanya adalah ….

Unsur yang dapat mempunyai bilangan oksidasi +7 dalam senyawanya adalah ….
| A. | P |
| B. | Q |
| C. | R |
| D. | S |
| E. | T |
Pembahasan
Bilangan oksidasi tertinggi suatu unsur tergantung dari golongannya. Unsur golongan IV dapat mempunyai biloks +4 dan tidak mungkin mempunyai biloks +5 atau lebih.Dengan demikian, unsur yang mungkin mempunyai bilangan oksidasi +7 adalah unsur dari golongan VII. Mari kita tentukan golongan masing-masing unsur di atas!
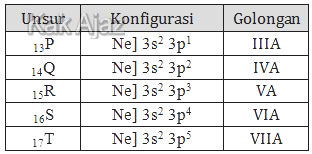
Jadi, unsur yang dapat mempunyai bilangan oksidasi +7 adalah unsur T (E).
Simak Pembahasan Soal TKA Saintek UTBK SBMPTN 2019 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan