- stoikiometri,
- laju reaksi,
- larutan penyangga,
- reaksi redoks dan elektrokimia, serta
- struktur atom.
Soal No. 31 tentang Stoikiometri
Gas nitrogen (N2, Mr 28) digunakan sebagai bahan dasar pupuk urea (NH2)2CO (Mr 60). Kalau pabrik pupuk dapat memproduksi 12 juta ton urea/tahun maka gas nitrogen/tahun yang digunakan adalah ….
A. 0,28 juta ton
B. 2,8 juta ton
C. 5,6 juta ton
D. 28 juta ton
E. 56 juta ton
A. 0,28 juta ton
B. 2,8 juta ton
C. 5,6 juta ton
D. 28 juta ton
E. 56 juta ton
Pembahasan
Kandungan gas nitrogen dalam urea adalah 2 unsur N sehingga sama dengan Mr gas nitrogen (N2). Dengan demikian, massa gas nitrogen yang dibutuhkan per tahun adalah: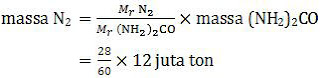
= 5,6 juta ton
Jadi, massa gas nitrogen yang digunakan per tahun adalah 5,6 juta ton (C).
Soal No. 32 tentang Laju Reaksi
Diketahui data percobaan dari reaksi:
2NO2 (g) → 2NO (g) + O2 (g)
Harga tetapan laju reaksi (k) berdasarkan data pada tabel adalah ….
A. 0,01 L mol−1 s−1
B. 7,10 × 10−5 s−1
C. 1,4 × 10−2 s−1
D. 0,71 L mol−1 s−1
E. 7,10 L mol−1 s−1
2NO2 (g) → 2NO (g) + O2 (g)
| Percobaan | [NO2] awal (M) | Laju reaksi awal (Ms−1) |
| 1 2 | 0,01 0,02 | 7,1 × 10−5 28,0 × 10−5 |
Harga tetapan laju reaksi (k) berdasarkan data pada tabel adalah ….
A. 0,01 L mol−1 s−1
B. 7,10 × 10−5 s−1
C. 1,4 × 10−2 s−1
D. 0,71 L mol−1 s−1
E. 7,10 L mol−1 s−1

Pembahasan
Laju reaksi (r) untuk reaksi di atas adalah:r = k [NO2]n
dengan k adalah tetapan laju reaksi dan n adalah orde reaksi.
Nilai n dapat ditentukan dengan membanding data pada percobaan 1 dan 2. Untuk lebih mudahnya, data yang lebih besar kita letakkan sebagai pembilang.
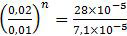
2n = 4
n = 2
Dengan demikian, persamaan laju reaksinya adalah:
r = k [NO2]2
Nah, sekarang kita tinggal memanfaatkan salah satu data pada tabel untuk mendapatkan nilai tetapan laju reaksi (k). Kita gunakan data yang paling sederhana, yaitu data pada percobaan 1.
r = k [NO2]2
7,1 × 10−5 = k × (0,01)2
7,1 × 10−5 = k × 10−5
k = 7,1 × 10−1
= 0,71
Jadi, harga tetapan laju reaksi berdasarkan data tersebut adalah 0,71 L mol−1 s−1 (D).
Soal No. 33 tentang Larutan Penyangga
Suatu larutan buffer dibuat dengan cara mencampurkan 0,6 mol asam asetat dan 0,2 mol NaOH dalam 500 mL larutan (Ka CH3COOH = 5 × 10−5). pH larutan tersebut adalah ….
A. 2
B. 3
C. 4
D. 5
E. 6
A. 2
B. 3
C. 4
D. 5
E. 6
Pembahasan
Larutan penyangga pada soal di atas terbentuk dari campuran asam lemah berlebih dan basa kuat. Reaksinya adalah sebagai berikut:| CH3COOH | + | NaOH | → | CH3COONa | + | H2O | |
| mula-mula | 0,6 mol | 0,2 mol | - | - | |||
| bereaksi | 0,2 mol | 0,2 mol | 0,2 mol | 0,2 mol | |||
| sisa | 0,4 mol | - | 0,2 mol | 0,2 mol |
Sisa asam lemah pada reaksi tersebut (0,4 mol) akan membentuk larutan penyangga dengan garam CH3COONa 0,2 mol. Larutan penyangga yang terbentuk adalah buffer asam sehingga perumusannya adalah:

= 10−4
pH = −log 10−4
= 4
Jadi, pH larutan penyangga tersebut adalah 4 (C).
Soal No. 34 tentang Reaksi Redoks dan Elektrokimia
Diketahui data potensial reduksi standar untuk:
Cd2+ + 2e− → Cd Eo = −0,40 V
Cr3+ + 3e− → Cr Eo = −0,74 V
Berdasarkan data tersebut, pernyataan berikut yang benar adalah …
A. Cd adalah reduktor yang lebih kuat daripada Cr.
B. Jika kedua reaksi setengah sel tersebut dihubungkan maka Cr3+ akan tereduksi menjadi Cr.
C. Pada anoda terjadi oksidasi Cd menjadi Cd2+.
D. Potensial sel elektrokimia yang terjadi adalah 0,34 V.
E. Pada katoda terjadi reduksi Cr3+ menjadi Cr.
Cd2+ + 2e− → Cd Eo = −0,40 V
Cr3+ + 3e− → Cr Eo = −0,74 V
Berdasarkan data tersebut, pernyataan berikut yang benar adalah …
A. Cd adalah reduktor yang lebih kuat daripada Cr.
B. Jika kedua reaksi setengah sel tersebut dihubungkan maka Cr3+ akan tereduksi menjadi Cr.
C. Pada anoda terjadi oksidasi Cd menjadi Cd2+.
D. Potensial sel elektrokimia yang terjadi adalah 0,34 V.
E. Pada katoda terjadi reduksi Cr3+ menjadi Cr.
Pembahasan
Di kimia tidak dikenal istilah potensial oksidasi, yang ada hanya potensial reduksi. Sehingga unsur yang potensial reduksi besar akan mengalami reduksi sedangkan unsur yang potensial reduksinya kecil akan mengalami oksidasi.Berdasarkan data pada soal, potensial reduksi Cd lebih besar daripada potensial reduksi Cr, sehingga:
- Cd mengalami reduksi (sebagai oksidator) dan bertindak sebagai katoda. [opsi A dan C salah]
- Cr mengalami oksidasi (sebagai reduktor) dan bertindak sebagai anoda. [opsi B dan E salah]
Eosel = Eokatoda − Eoanoda
= −0,40 − (−0,74)
= −0,40 + 0,74
= 0,34 volt [opsi D benar]
Jadi, pernyataan yang benar adalah opsi (D).
Soal No. 35 tentang Struktur Atom
Koordinat bilangan kuantum elektron terluar atom 19K yang benar adalah ….
A. (4, 0, 0, +½) atau (4, 0, 1, +½)
B. (4, 0, 1, −½) atau (4, 0, 0, −½)
C. (4, 0, 0, +½) atau (4, 0, 0, −½)
D. (4, 1, 1, +½) atau (4, 1, 1, −½)
E. (4, 0, 1, +½) atau (4, 1, 1, −½)
A. (4, 0, 0, +½) atau (4, 0, 1, +½)
B. (4, 0, 1, −½) atau (4, 0, 0, −½)
C. (4, 0, 0, +½) atau (4, 0, 0, −½)
D. (4, 1, 1, +½) atau (4, 1, 1, −½)
E. (4, 0, 1, +½) atau (4, 1, 1, −½)
Pembahasan
Untuk menentukan bilangan kuantum elektron terluar suatu atom, kita harus menentukan konfigurasi elektron atom tersebut.19K : [Ar] 4s1
Berdasarkan konfigurasi elektron tersebut, elektron terluar terletak pada 4s1, artinya terletak pada:
- kulit ke-4 (n = 4)
- subkulit s (l = 0) [s = 0, p = 1, d = 2, f = 3]

Dengan demikian, bilangan kuantum elektron terluar dari atom 19K adalah:
n = 4, l = 0, m = 0, s = +½ atau
n = 4, l = 0, m = 0, s = −½
Dalam bentuk koordinat bilangan kuantum, bisa ditulis:
(4, 0, 0, +½) atau (4, 0, 0, −½)
Jadi, keempat bilangan kuantum untuk atom 19K yang benar adalah opsi (C).
Simak Pembahasan Soal TKD Saintek SBMPTN 2014 selengkapnya.
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

No comments:
Post a Comment
Maaf, komentar yang tidak berhubungan dengan konten, banyak mengandung singkatan kata, atau mengandung link aktif, tidak kami tayangkan.
Komentar Anda akan kami moderasi sebelum kami tayangkan. Centang 'Notify me' agar Anda mendapat pemberitahuan lewat email bahwa komentar Anda sudah ditayangkan