- kesetimbangan kimia,
- senyawa karbon,
- kelarutan dan hasil kali kelarutan,
- hidrokarbon, serta
- ikatan kimia.
Soal No. 41 tentang Kesetimbangan Kimia
Dalam wadah 1 L terdapat 20 g H2, 28 g N2, dan sejumlah NH3 dalam kesetimbangan pada 300 °C. Jika gas NH3 dalam kesetimbangan tersebut dipisahkan dan dilarutkan 1 L air maka pH larutan yang diperoleh adalah … (Kb NH4OH = 10−5).
A. 8
B. 9
C. 10
D. 11
E. 12
A. 8
B. 9
C. 10
D. 11
E. 12
Pembahasan
Soal ini berkaitan dengan soal nomor 39 di Pembahasan Kimia No. 36 - 40 TKD Saintek SBMPTN 2014 Kode Naskah 512.Reaksi yang terjadi adalah:
3H2 + N2 ⇌ 2NH3
Dalam wadah 1 L terdapat 20 g H2, 28 g N2 dalam kesetimbangan, konsentrasi molarnya adalah:
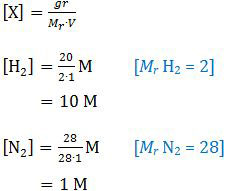
Pada soal no. 39 disebutkan bahwa harga Kc pada suhu 300 °C adalah 1 × 10−5. Perumusan Kc untuk reaksi tersebut adalah:
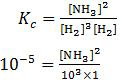
[NH3]2 = 10−2
[NH3] = 10−1
Kemudian NH3 dipisahkan dan dilarutkan dalam air.
NH3 + H2O → NH4OH
Pada reaksi tersebut terbentuk larutan NH4OH yang bersifat basa lemah. pH basa lemah dirumuskan sebagai:
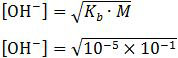
= 10−3
pOH = −log 10−3
= 3
pH = 14 − pOH
= 14 − 3
= 11
Jadi, pH larutan NH4OH adalah 11 (D).
Soal No. 42 tentang Senyawa Karbon
Asam asetat dalam air bersifat lebih asam dibandingkan dengan asam propanoat.
SEBAB
CH3−CH2− dapat mendorong elektron lebih kuat dibandingkan CH3−. 
Pembahasan
Asam asetat (asam etanoat) dan asam propanoat termasuk dalam golongan asam karboksilat.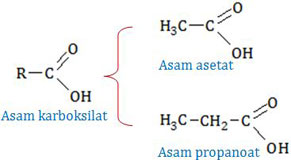
Keasaman asam karboksilat bergantung panjang gugus alkilnya, semakin pendek semakin asam. Asam asetat mempunyai gugus alkil CH3− sedangkan asam propanoat mempunyai gugus alkil CH3−CH2− sehingga asam asetat lebih asam daripada asam propanoat. [pernyataan benar]
Semakin panjang gugus alkil, semakin kuat mendorong elektron sehingga ion H+ semakin terikat (sulit melepas ion H+). Akibatnya, sifat keasaman semakin lemah. [alasan betul]
Jadi, pernyataan dan alasan pada soal tersebut benar serta saling berhubungan sehingga jawabannya adalah (A).
Soal No. 43 tentang Kelarutan dan Hasil Kali Kelarutan
Kelarutan garam MgCO3 dalam air pada pH 9 lebih kecil daripada kelarutannya pada pH 5.
MgCO3(s) + H2O ⇌ Mg2+(aq) + HCO3−(aq) + OH−(aq).
SEBAB
Pelarutan MgCO3 dalam air membentuk kesetimbangan:MgCO3(s) + H2O ⇌ Mg2+(aq) + HCO3−(aq) + OH−(aq).
Pembahasan
MgCO3 adalah garam yang bersifat basa sehingga jika dilarutkan dalam air akan menghasilkan ion OH−.MgCO3 + H2O ⇌ Mg2+ + HCO3− + OH−
Garam yang bersifat basa akan sulit larut dalam larutan basa (pH tinggi). pH tinggi ini akan mengakibatkan konsentrasi OH− semakin tinggi sehingga reaksi akan bergeser ke kiri. Artinya kelarutan MgCO3 semakin kecil. Sebaliknya garam yang bersifat basa akan mudah bereaksi dengan lautan asam (pH rendah).
Dengan demikian, kelarutan MgCO3 akan lebih kecil dalam air dengan pH 9 daripada kelarutannya pada pH 5.
Jadi, pernyataan dan alasan keduanya benar serta saling berhubungan sehingga jawabannya adalah (A).
Soal No. 44 tentang Hidrokarbon
n-butana memiliki titik didih lebih tinggi daripada isobutana. Pernyataan yang dapat menjelaskan perbedaan titik didih kedua senyawa tersebut adalah ….
- luas bidang kontak antarmolekul n-butana lebih besar
- interaksi polar-polar pada n-butana lebih besar
- gaya London antarmolekul n-butana lebih kuat
- molekul n-butana lebih berat
Pembahasan
n-butana dan isobutana adalah dua senyawa yang termasuk golongan alkana. Keduanya mempunyai rumus molekul sama tetapi strukturnya berbeda. n-butana mempunyai rantai lurus sedang isobutana rantainya bercabang.
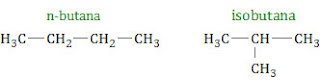
Dengan struktur rantai lurus, n-butana mempunyai titik didih lebih tinggi daripada isobutana. Hal ini disebabkan:
- luas bidang kontak antarmolekul n-butana yang memanjang cenderung lebih besar daripada bidang kontak isobutana yang mengumpul [pernyataan 1 benar]
- gaya London antarmolekul n-butana lebih kuat sehingga membutuhkan suhu yang lebih tinggi untuk memisahkannya [pernyataan 3 benar]
- karena mempunyai gaya London yang lebih kuat, interaksi polar-polar n-butana juga lebih besar daripada isobutana [pernyataan 2 benar]
Jadi, pernyataan yang benar adalah pernyataan 1, 2, dan 3 sehingga jawabannya adalah (A).
Soal No. 45 tentang Ikatan Kimia
Hasil analisis terhadap struktur molekul NH3 dan NCl3 menunjukkan bahwa ….
- struktur molekul NH3 dan NCl3 sama, yaitu piramida segitiga
- kepolaran molekul NH3 lebih besar daripada molekul NCl3
- titik didih NH3 lebih besar dari NCl3
- energi ikatan N-H lebih kecil daripada N-Cl
Pembahasan
Molekul NH3 dan NCl3 mempunyai atom pusat yang sama, yaitu N. Atom pusat N (golongan V, valensi 5) mempunyai 5 elektron terluar. Dari 5 elektron terluar tersebut, 3 elektron digunakan untuk berikatan dengan atom H atau Cl sehingga tersisa 2 elektron (sepasang elektron) bebas. Oleh karena itu, kedua molekul tersebut mempunyai tipe AX3E dengan bentuk molekul segitiga piramida. [pernyataan 1 benar]Molekul NH3 dan NCl3 adalah senyawa polar, tetapi kepolaran NH3 lebih besar. Hal ini karena beda keelektronegatifan NH3 lebih besar daripada NCl3 (bisa dibandingkan jarak letak N terhadap H dan jarak N terhadap Cl pada tabel sistem periodik). [pernyataan 2 benar]
Antarmolekul NH3 terjadi ikatan hidrogen sehingga ikatannya lebih kuat. Dengan adanya ikatan hidrogen ini:
- titik didih NH3 lebih besar dari NCl3 [pernyataan 3 benar]
- energi ikatan N-H lebih besar daripada N-Cl [pernyataan 4 salah]
Simak Pembahasan Soal TKD Saintek SBMPTN 2014 selengkapnya.
Simak juga:
Pembahasan Kimia SBMPTN 2015
Pembahasan Kimia SBMPTN 2016
Pembahasan Kimia SBMPTN 2017
Pembahasan Kimia UTBK SBMPTN 2019
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

sangat bermanfaat kak blog'nya ;3 terimakasih banyakkk
ReplyDeleteTerima kasih juga Lila atas apresiasinya.
DeleteAku nyoba ngerjain sendiri. dan ternyata jawaban aku hampir benar semua. Untung ada blog ini jadi tau deh aku benar atau salah.
ReplyDeleteTerimakasih banyak kak. Ini sangat membantu dan bermanfaat banget 😇
Sama-sama. Semoga bermanfaat dan sukses selalu untuk adik Jenifer.
Delete