
Pembahasan soal Kimia Ujian Nasional (UN) tahun 2019 nomor 16 sampai dengan nomor 20 tentang:
- termokimia [energi ikatan],
- laju reaksi,
- kesetimbangan kimia [pergeseran kesetimbangan],
- kesetimbangan kimia, dan
- laju reaksi [faktor pemercepat reaksi].
Soal No. 16 tentang Termokimia [energi ikatan]
Diketahui data energi ikatan rata-rata:
H – H = 436 kJ/mol
H – Cl = 431 kJ/mol
Cl – Cl = 242 kJ/mol
Besarnya perubahan entalpi pada penguraian 7,30 gram HCl (Mr = 36,5) menurut reaksi:
2HCl(g) → H2(g) + Cl2(g) adalah ….
A. −84 kJ
B. −18,4 kJ
C. +18,4 kJ
D. +38,8 kJ
E. +184 kJ
H – H = 436 kJ/mol
H – Cl = 431 kJ/mol
Cl – Cl = 242 kJ/mol
Besarnya perubahan entalpi pada penguraian 7,30 gram HCl (Mr = 36,5) menurut reaksi:
2HCl(g) → H2(g) + Cl2(g) adalah ….
A. −84 kJ
B. −18,4 kJ
C. +18,4 kJ
D. +38,8 kJ
E. +184 kJ
Pembahasan
Karena disebutkan penguraian HCl maka koefisien HCl harus sama dengan satu.2HCl → H2 + Cl2
HCl → ½H2 + ½Cl2
H – Cl → ½(H – H) + ½(Cl – Cl)
Perubahan entalpinya merupakan hasil pengurangan energi ikatan ruas kiri terhadap ruas kanan.
∆H = 431 − ½(436 + 242)
= 431 − 339
= 92
Nilai di atas merupakan perubahan entalpi penguraian untuk 1 mol HCl. Sedangkan jumlah HCl yang disajikan dalam soal belum tentu 1 mol.
mol HCL = gr/Mr
= 7,30/36,5
= 0,2
Dengan demikian perubahan entalpi penguraian 02, mol HCl adalah:
∆H = 0,2 × 92
= 18,4
Jadi, besar perubahan entalpi pada penguraian 7,30 gram HCl adalah +18,4 kJ (C).
Perdalam materi ini di Pembahasan Kimia UN: Termokimia.
Soal No. 17 tentang Laju Reaksi
Pada penentuan laju reaksi H2(g) + O2(g) → 2H2O(l), diperoleh data percobaan sebagai berikut:
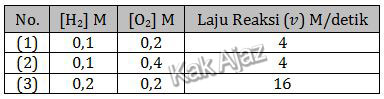
Orde reaksi total dari reaksi tersebut adalah ….
A. 0
B. 1/2
C. 1
D. 2
E. 3

Orde reaksi total dari reaksi tersebut adalah ….
A. 0
B. 1/2
C. 1
D. 2
E. 3
Pembahasan
Kita tentukan dulu orde reaksi masing-masing pereaksi. Orde reaksi H2 bisa ditentukan saat molaritas O2 tetap, yaitu percobaan (3) dan (1).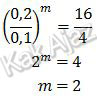
Demikian juga orde O2, bisa ditentukan saat molaritas H2 tetap, yaitu percobaan (2) dan (1).
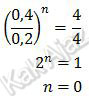
Orde reaksi total adalah jumlah orde reaksi dari kedua orde reaksi tersebut.
m + n = 2 + 0
= 2
Jadi, orde reaksi total dari reaksi tersebut adalah 2 (D).
Perdalam materi ini di Pembahasan Kimia UN: Laju Reaksi.
Soal No. 18 tentang Kesetimbangan Kimia [pergeseran kesetimbangan]
Gas amonia di dalam industri dibuat dari campuran gas nitrogen dan gas hidrogen melalui reaksi kesetimbangan yang bersifat eksoterm berikut:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Untuk memperoleh amonia yang maksimal. Reaksi harus bergeser ke arah pembentukan amonia. Upaya yang tepat agar diperoleh amonia secara maksimum adalah ….
A. suhu dinaikkan setinggi mungkin
B. tekanan diturunkan
C. volume diperbesar
D. diberikan inhibitor
E. konsentrasi gas N2 dan H2 diperbesar
N2(g) + 3H2(g) ⇌ 2NH3(g)
Untuk memperoleh amonia yang maksimal. Reaksi harus bergeser ke arah pembentukan amonia. Upaya yang tepat agar diperoleh amonia secara maksimum adalah ….
A. suhu dinaikkan setinggi mungkin
B. tekanan diturunkan
C. volume diperbesar
D. diberikan inhibitor
E. konsentrasi gas N2 dan H2 diperbesar

Pembahasan
Gas amonia (NH3)berada di ruas kanan. Agar diperoleh gas amonia secara maksimum maka reaksi harus bergeser ke kanan.Reaksi akan bergeser ke kanan jika:
- volume diperkecil (jumlah koefisien ruas kanan lebih kecil)
- tekanan diperbesar (kebalikan volume)
- suhu diturunkan (eksoterm)
- konsentrasi ruas kiri diperbesar
Jadi, agar diperoleh amonia secara maksimum maka konsentrasi gas N2 dan H2 diperbesar (
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 19 tentang Kesetimbangan Kimia
Perhatikan pernyataan berikut!
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
- Zat cair dalam wadah tertutup akan menguap hingga habis.
- Proses pengembunan terjadi setelah proses penguapan selesai.
- Laju penguapan sama dengan laju pengembunan.
- Tidak ada perubahan jumlah air dan uap air yang dapat diamati.
A. (1) dan (2)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan
Mari kita analisis setiap pernyataan di atas!- Jika dipanaskan dalam wadah tertutup, zat cair akan menguap tapi volumenya tidak akan berkurang apalagi habis. [pernyataan 1 salah]
- Penguapan terus berlanjut sampai terjadi kesetimbangan. Pada keadaan setimbang, jumlah molekul zat cair yang menguap meninggalkan cairan akan sama dengan jumlah molekul zat cair yang mengembun masuk ke dalam cairan. [pernyataan 2 salah]
- Pada keadaan setimbang, laju reaksi ke ruas kiri sama dengan laju reaksi ke ruas kanan sehingga laju penguapan sama dengan laju pengembunan. [pernyataan 3 benar]
- Penguapan dan pengembunan zat cair terjadi secara mikroskopis sehingga tidak dapat diamati secara kasat mata. [pernyataan 4 benar]
Perdalam materi ini di Pembahasan Kimia UN: Kesetimbangan Kimia.
Soal No. 20 tentang Laju Reaksi [faktor pemercepat reaksi]
Seorang siswa melakukan percobaan faktor-faktor yang memengaruhi laju reaksi dengan mereaksikan 25 cm3 larutan HCl dan 2 gram pualam (CaCO3) sebagai berikut:
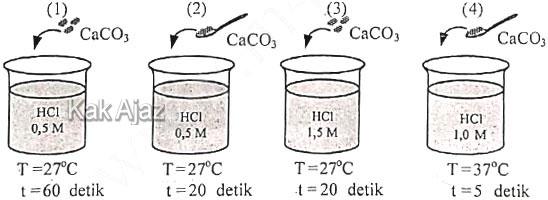
Kondisi yang diharapkan adalah:
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)

Kondisi yang diharapkan adalah:
- variabel bebas : konsentrasi HCl
- variabel tetap : luas permukaan CaCO3 dan suhu
- variabel terikat : waktu dan laju
A. (1) dan (2)
B. (1) dan (3)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.
Pembahasan
Langkah pertama adalah menentukan variabel tetap dulu. Karena variabel tetapnya luas permukaan CaCO3 dan suhu maka kita cari dua pasangan gambar yang mempunyai luas permukaan CaCO3 dan suhunya sama.Ya, pasangan gambar (1) dan (3). Pada kedua gambar tersebut, CaCO3 berbentuk butiran dan suhunya 27 ℃.
Selanjutnya kita amati variabel bebas (konsentrasi HCl). Gambar (1) konsentrasi HCl 0,5 M sedangkan gambar (3) konsentrasi HCl 1,5 M. Berarti benar variabel bebasnya diubah.
Terakhir kita amati variabel terikat (waktu). Ternyata memang waktunya berubah.
Jadi, Pasangan gambar tepat adalah gambar 1 dan 3 (B).
Perdalam materi ini di
Pembahasan Kimia UN: Laju Reaksi
Pengertian Variabel Bebas, Tetap, dan Terikat
Simak Pembahasan Soal Kimia UN 2019 selengkapnya.
| No. 01 - 05 | No. 21 - 25 | ||||
| No. 06 - 10 | No. 26 - 30 | ||||
| No. 11 - 15 | No. 31 - 35 | ||||
| No. 16 - 20 | No. 36 - 40 |
Dapatkan pembahasan soal dalam file pdf di sini.
Demikian, berbagi pengetahuan bersama Kak Ajaz. Silakan bertanya di kolom komentar apabila ada pembahasan yang kurang jelas. Semoga berkah.

Mohon maaf ingin mengklarifikasi soal no 18 ada kesalahan dalam penulisan opsi di kunci jawaban. Harusnya menuliskan (E) tapi ditulis (B). Kemudian link untuk no 11 - 15 masih tidak aktif. Terimakasih
ReplyDeleteTerima atas koreksinya, Dian Nur Fajariati. Kesalahan sudah saya perbaiki.
DeleteUntuk no. 11-15 bisa dicari lewat google sesuai judul